Proseguiamo l'analisi sul controllo e la prevenzione delle infezioni in ICU; nel capitolo recedente abbiamo iniziato ad accennare al problema mostrando come lo sviluppo di tali infezioni resistenti sia un insieme di fattori legati al paziente ed alla patologica che lo porta in ICU, all'uso di antibiotici non sempre in maniera corretta (farmacologicamente, spettro d'azione, durata, ecc...) ed all'igiene fra un paziente e l'altro (si veda il capitolo dedicato, Capitolo 6.3.1). In questo capitolo ci concentreremo maggiormente sull'ecologia microbiologica, vale a dire soprattutto sulle caratteristiche intrinseche di alcune popolazioni di germi definite come multi-resistenti. Non si vuole fare un trattato esaustivo delle popolazioni microbiologiche (condizione che sarebbe impossibile da riassumere in qualche riga, né utile dal punto di vista pratico), quanto segnalare alcune peculiarità specifiche di alcuni germi multiresistenti che possano aiutare nella pratica clinica quotidiana.
Con lo sviluppo di nuove metodologie in ambito microbiologico, ad oggi l’identificazione di germi multiresistenti può essere confermata in maniera rapida, anche entro 1 ora dalla politicizzazione delle emocolture. Il tempo che ancora oggi risulta maggiormente impiegato nell’identificazione dei batteri é soprattutto il tempo di trasporto delle bottiglie in incubatore, che arriva a sfiorare le 4 ore. La determinazione di resistenza avviene secondo il fenotipo di resistenza agli antibiotici (metodo classico) classificando i germi in sensibili, intermedi o resistenti ad un determinato antibiotico sulla base della MIC ed in accordo con i criteri internazionali (criteri CLSI oppure i criteri EUCAST). Esiste anche la possibilità di eseguire un sequenziamento genico in modo da ottenere l’analisi genetica del battere, dato che oramai é noto come la presenza di determinati geni comporti automaticamente la resistenza a determinati antibiotici. Il vantaggio del metodo fenotipo é che permette di quantificare la resistenza in vivo, anche se richiede più tempo rispetto al metodo genetico. Negli anni la proporzione di infezioni da Gram positivi e funghi sta crescendo e spesso sono più frequenti le infezioni da Gram positivi che da Gram negativi; nelle ICU pediatriche sono annoverati soprattutto gli Staphylococcus coagulasi negativi (38%), seguiti dagli Enterococchi e dallo S. aureus; seguono infine i Gram negativi (25%), in particolare gli Enterobacetriaceae.
GENERALITÀ BATTERICHE:
I batteri sono degli organismi procarioti unicellulari, rappresentando i maggiori patogeni (in termini numerici) delle specie animali e umane; lo studio dettagliato dei batteri è utile per porre una corretta diagnosi differenziale fra le diverse patologie ed individuare gli elementi di differenza dagli eucarioti, che permettono di identificare nuovi bersagli farmacologici. Per quello che riguarda la loro struttura generale é presente un nucleoide che rappresenta la zona batterica dove si localizza il DNA batterico, legato al mesosoma nel suo punto di origine di replicazione (chiamato Ori-c). Il DNA è sempre circolare (tranne nella B. burgoderferi che lo possiede in forma lineare); i batteri sono aploidi, cioè contengono una sola copia per ciascun gene, anche se una definizione più precisa vede una loro classificazione come merodiploidi, dato che grazie alla presenza di plasmodi circolari, per alcuni geni si hanno doppie copie. I mesosomi inizialmente si pensava fossero zone particolari per l’inizio della replica genomica batterica, mentre l’ipotesi attuale è che si sia trattato di artefatti di fissazione. Infine i granuli insolubili sono granuli intracellulari che contengono il “materiale di riserva” della cellula. I più rappresentati sono l’acido poli-ß-idrossibutirrico ed i granuli di Volutina.
L’involucro cellulare é una struttura estremamente variabile, che caratterizza la superfamiglia dei Gram Positivi e Gram Negativi, determinandone una prima grossa classificazione, struttura e profilo farmacologico; i gram positivi posseggono la membrana cellulare ed uno strato di peptidoglicano; i gram negativi sono rivestiti esternamente anche da una membrana esterna. I micobatteri posseggono all’esterno delle cere (acidi micolici). All’esterno esisto lo strato S (strato cristallino), composto da subunità proteiche ripetute fra loro, la cui funzione non è stata ancora chiarita; forse hanno implicazioni con la selettività dei metaboliti, con l’adesione cellulare, ecc… La membrana cellulare é una membrana a doppio strato lipidico, cui sono annesse delle proteine transmembrana; è una struttura comune a tutti i batteri. Le funzioni principali della membrana sono soprattutto la selettività, il trasporto regolato attivo/passivo, la formazione di ATP (similmente ai mitocondri), un’attività recettoriale e permette il movimento di flagelli (con consumazione di 256 ioni idrogeno per un giro di flagello). La capsula batterica é uno strato glicolipidico molto fitto (mentre la presenza di un “glicocalice” indica uno strato più rado), etero/omopolimerico che é presente in vivo, quasi mai in vitro. Svolge diverse funzioni, fra cui un’azione anti-antigenica (maschera gli Ag di superficie), un’azione anti-complemento (lega le porzioni Fc e blocca gli anticorpi), un’azione di aderenza intercellulare ed un’azione di blocco farmacologico (per le cariche negative presenti sulla sua superficie).
CLASSIFICAZIONE BATTERICA:
La classificazione batterica è la distribuzione dei microrganismi in gruppi tassonomici basati su somiglianza e correlazioni. Dal punto di vista morfologico i batteri possono essere classificati sulla differente forma della parete cellulare (cocchi, bacilli, spirilli), sulla differente disposizione intercellulare (a catenelle, a grappolo, diplococchi, ecc…), condizione legata alla formazione di legami post-mitotici ed anche sulla differente colorazione (gram positivi/negativi, BAAR, colorazione argentica, ecc…). Dal punto di vista biochimico si ha la classificazione più utile ed utilizzata; si parla di batteri aerobi/anaerobi (valutando anche la possibilità di meccanismo facoltativo e/o microaerofilo), delle differenti necessità metaboliche per crescere (ottime informazioni per la crescita/inibizione della proliferazione batterica) e della presenza di enzimi specifici (alcuni esempi sono le coagulasi, le catalani, ecc…).
Esiste anche una classificazione sierologica, metodo utilizzato quando gli studi biochimici risultano insufficienti, che sfrutta la presenza di anticorpi contro i diversi antigeni di superficie; viene utilizzato soprattutto per una sottotipizzazione batterica (esempio per le Enterobaceriaceae) e generalmente a scopo epidemiologico. Tramite il metodo fagico si utilizzano i fagi per il tropismo batterico, valutando il DNA in essi contenuto dopo traduzione; è un metodo molto utilizzato perché estremamente rapido e con buoni risultati. Solitamente si accoppia un metodo molecolare. La classificazione tramite metodo molecolare rappresenta il metodo più diretto per lo studio del DNA, che utilizza una PCR per studi parziali di DNA (ottenuto mediante enzimi di restrizione e/o fagi) mediante PFGE (Pulse Field Gel Electrophoresis) così da avere una migrazione “a spirale” del gel. Segue poi sequenziamento genomico.
GRAM POSITIVI:
I batteri appartenenti alla superclasse dei gram positivi sono dei batteri selezionati in base alle caratteristiche morfologiche dell’involucro nucleare. Possiedono al loro interno una membrana plasmatici, circondata da una parete cellulare caratteristica, che determina la loro classificazione. La parete cellulare è formata da uno strato di peptidoglicano, polimero a catene intrecciate; ha una struttura alternata di N-acetilglucosamina ed acido N-acetilmuramico, legati con legami ß-1,4 (2-3 strati nei Gram negativi, 400 strati nei Gram positivi). Da questa struttura si diramano altre catene necessarie per l’intreccio, solitamente un pentapeptide caratteristico per ogni ceppo batterico. Solitamente il pentapeptide é formato da L-Ala - D-Glu - L-Lys - D-Ala - D-Ala ed il legame fra gli ultimi due aminoacidi viene scisso per creare dei legami crociati fra D-Ala ed un’altra L-Lys mediante ponti di penta-Gly. Nei gran negativi a volte il legame crociato é dato da D-Ala e l’acido diaminopimelico (precursore della Lys), componente necessario per l’accrescimento batterico. L’acido teicoico è un polimero idrosolubile con residui di glicerolo, legati da legami fosfodiesterici, con uno o più aminoacidi/sostituti glicidici; gli acidi teicoici della parete sono legati covalentemente al peptidoglicano (é comunque uno strato non sempre presente), mentre gli acidi teicoici della membrana (come l’acido lipoteicoico) sono legati ai glicolipidi e sono concentrati nei mesosomi (presente in tutti i ceppi batterici). Gli acidi teicoici sono i principali antigeni di superficie, e la loro antigenicità aumenta con la distruzione della parete (indicando un chiaro coinvolgimento antigienico in tale struttura); la loro funzione non è stata ancora ben chiarita, ma è noto che legano gli ioni di Mg e di K per fornirli alla cellula, così come è noto che un’assenza di tale molecola porta a lisi cellulare. L’acido teicuronico è molto simile all’acido teicoico, ma al posto dell’acido fosforico si ha un acido glucidico; tale molecola viene sintetizzata al posto dell’acido teicoico in mancanza di fosfato, utilizzando granuli di volutina.
GRAM NEGATIVI:
I tram negativi sono una superfamiglia di batteri classificata secondo le caratteristiche morfologiche dell’involucro cellulare; posseggono una membrana cellulare, un sottile strato di peptidoglicano, una membrana esterna e dei LPS (lipo-poli-saccaridi) di superficie. La membrana cellulare è molto simile a quella degli altri batteri; la struttura del peptidoglicano è simile a quella dei Gram positivi (a volte con legami crociati fra D-Ala e Acido diaminopimelico), con 2-3 strati, localizzato nel periplasma. Alcune proteine si legano covalentemente all’acido diaminopimelico e si inseriscono nella membrana cellulare (legami idrofobici), così da ancorare la membrana al peptidoglicano. La loro membrana esterna è un doppio strato di fosfolipidi e proteine transmembrana, disposti in maniera asimmetrica per composizione lipidica; é impermeabile alle molecole idrofiliche ed idrofobiche (LPS), proteggendole ad esempio dai sali biliari. Sono attraversati da porine che permettono l’ingresso per diffusione passiva delle sostanze necessarie alla cellula; sono molecole trimeriche e selettive sia di tipo aspecifico (OmpC, OmpD, OmpE, PhoE), sia glucidi ed aminoacidi (come LamB e Tsx) sia recettori di fagi e piloF (come OmpA). Tali molecole si localizzano sulla membrana esterna, assieme a proteasi, fosfolipasi e PBP; le proteine transmembrana sono sintetizzate da ribosomi legati alla membrana interna citosolica, uscendo nel periplasma in alcune zone di contatto fra le due membrane (chiamate giunzioni di Bayer). Il lipopolisaccaride è un composto formato da un lipide complesso (Lipide A), unità disaccaridiche con legati a sé numerosi acidi grassi per ancorarsi alla membrana cellulare; a tale molecole si lega a sua volta un Core Polisaccaridico (analogo in tutti i ceppi batterici), crociato con altri Core mediante cationi bivalenti. E’ il LPS che determina l’impermeabilità della membrana esterna, anche a molecole idrofobiche. Il LPS con un core polisaccaridico semplice prende il nome di Antigene O, mentre se la struttura è più ramificata si parla di Antigene R. Il periplasma è lo spazio compreso fra le due membrane dei Gram negativi; di consistenza simile ad un gel, contiene numerose proteine leganti specifici substrati (enzimi idrolitici), così da creare e selezionare le molecole in grado di entrare nelle cellule. In esso è anche contenuto un polimero di destrosio (D-glucosio) ratificato, atto a controllare la Pressione Osmotica batterica.
SPORE BATTERICHE:
Fra i batteri di interesse medico, le specie sporigene sono i Clostridium spp e Bacillus spp (entrambi Gram positivi); posseggono una struttura molto piccola, resistente all’ambiente e difficile da colorare, dato che è disidratata; il citosol contiene il cromosoma batterico, ribosomi ed altre proteine (anche se esiste una bassissima sintesi proteica), la membrana/parete cellulare appare molto rudimentale, la corteccia è una struttura formata da peptidoglicano (con una elevata stabilità e spessore), ricco di acido dipicolinico (forte chelante del calcio, così da renderla estremamente resistente), i rivestimenti sono due (interno/esterno) con proteine molto stabili ed un 1-2% di lipidi, creando una struttura simil-cheratinica e l’esosporio è una struttura formata da fosfolipidi ricchi di acidi teicoici.
La funzione della sporulazione si pensa che sia una condizione alternativa alla scissione binaria, sia funzionale per le cellule in mancanza di condizioni ambientali ottimali e possa permettere loro un’ottima capacità di resisten ad un ambiente sfavorevole. Dal punto di vista della morfogenesi tali batteri sono delle endospore (si creano dallo nello sporangio per sua disgregazione), dove si ha una replica del DNA (che si localizza agli estremi della cellula), si crea un setto della membrana cellulare (pre-spora), cui segue la formazione delle altre membrane, l’esosporio e la disintegrazione dello sporangio. Per quello che riguarda la resistenza la spora appare estremamente resistente, dato che è in grado di resistere secoli (sono state ritrovate anche in tombe egizie), di resistere ai raggi UV, al calore, nello spazio, ecc…, ed é inoltre ben dimostrato anche dal fatto che sono estremamente difficili da eliminare. Si parla di germinazione quando si ha il passaggio dalla spora alla forma germinativa; generalmente é uno step che necessita un’attivazione (il cui meccanismo è poco chiaro, forse per un danno locale alla membrana), cui segue un’idratazione, un incremento delle dimensioni ed una esocrescita, che avviene in condizioni favorevoli per lo sviluppo del batterio.
GENETICA BATTERICA (CENNI):
L’unità fondamentale dell’eredità cellulare è il gene, definito come segmento di DNA contenente le informazioni per un determinato carattere biochimico. Si possono studiare i geni sulla base del fenotipo batterico (che è l’insieme delle proprietà strutturali e fisiologiche di una cellula) per la determinazione del genotipo batterico (sequenza di DNA che contiene alcuni geni necessari per l’espressione di un determinato genotipo). Il genotipo batterico (cromosoma e diversi plasmidi batterici) si basa sull’assunzione della crescita dei microrganismi in condizioni di selezione che permetta l’individuazione di un determinato genotipo. I plasmidi partecipano al fenotipo batterico ma non contengono informazioni vitali per la vita cellulare in condizioni normali.
CROMOSOMA BATTERICO:
E’ unico, a forma circolare (lineare solamente nella B. burgdorferi), a diretto contatto con il citosol, di circa 4.000 kbp; la replicazione cromosomica avviene da un punto di origine vicino al mesosoma settale (chiamato Ori-c) e da qua alcuni enzimi agiscono srotolando il DNA (elicasi), portano all’apertura delle eliche che si legano ai mesosomi che si allontanano fra loro, scorrendo in direzioni opposte, attuando la replica mediante DNA-polimerasi. Il traspone é una porzione di DNA contenente le informazioni per migrare da un locus genico all’altro; i trasposti possono essere semplici (quando sono semplici sequenze d’inserzione) o complessi (quando contengono geni a funzione speciale). Si replicano in maniera dipendente dal segmento genico in cui sono inseriti, ma possono traslocare da una parte all’altra del genoma, formando copie di se stessi. Il replicone é una porzione di DNA (sia plasmidico che cromosomico) che contiene le informazioni necessarie alla propria replicazione.
SCAMBIO GENICO:
E’ un meccanismo che avviene frequentemente nei batteri della stessa specie o di specie differenti; è dato dal trasferimento di un piccolo frammento di DNA proveniente dal menoma del donatore. Per quello che concerne la restrizione molti batteri posseggono al loro interno enzimi di restrizione che tagliano il DNA in punti ben precisi, necessari per la loro introduzione/escissione. Il proprio DNA è mutilato, proteggendolo dall’azione di questi enzimi. Esiste un meccanismo di tipo I (endonucleasi e metilasi nello stesso enzima) o di tipo II (endonucleasi e metilasi separate), con una selezione plasmidica di quelli che saranno i peptidi o le sequenze in grado di entrare nella cellula. Si parla di plasmide compatibile per una determinata linea cellulare. Per quello che concerne la ricombinazione il gene Rec permette la ricombinazione omologa fra un gene cromosomica ed un DNA a sequenza molto simile. La ricombinazione non omologa è data da proteine codificate dal DNA integrato, che permettono l’introduzione della nuova sequenza (trasposone).
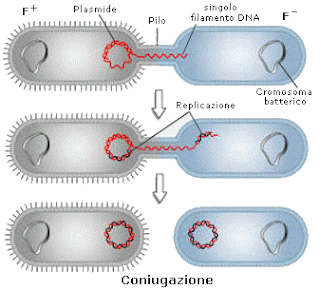
Il processo di scambio genico prevede che in differenti maniere il DNA della cellula donatrice possa arrivare nella cellula ricevente ed integrare il suo genotipo; le modalità sono prevalentemente tre. La coniugazione utilizza plasmidi auto-trasmissibili (mediante il gene Tra), come ad esempio negli E. coli mediante plasmide dotato di fattore di sensibilità (Fattori F), in grado di creare Hfr (high frequency of recombination) o mediante i plasmidi di resistenza (Fattori R) che possono essere trasferiti fra i diversi batteri, dando loro un nuovo fenotipo antibiotico-resistente. La traduzione è la ricombinazione genica mediata da fagi, che può essere generalizzata/specializzata; il fago è una porzione di DNA batterico trasportata da un fago. Più fagi che infettano un batterio sono co-trasduttori. Il loro ampio utilizzo in ingegneria genetica è giustificato dall’elevata velocità di replica. La trasformazione é invece la captazione diretta del DNA donatore; non tutti i batteri di default effettuano tale meccanismo; sono necessari i fattori di competenza, prodotti solamente in un unico punto del ciclo di crescita. Per tutti gli altri batteri, incapaci di trasformazione, si può ottenere tale meccanismo mediante shock termico e/o CaCl2.
PATOGENICITÀ BATTERICA:
I batteri possono essere classificati sulla base della loro patogenicità in batteri con vita saprofitica, cioè che vivono nell’ambiente a spese del materiale inanimato e con vita parassitaria, cioè batteri che vivono a carico di organismi superiori. Fra i batteri parassiti si hanno quelli facoltativi o obbligati, dove in quest’ultimo caso la loro crescita è legata all’ospite. Fra i batteri capaci di dare vita parassitaria abbiamo i batteri simbionti (che possono essere utili all’ospite), i batteri commensali (che generalmente sono indifferenti all’ospite, se l’ospite é immunocompetente) e batteri patogeni (che si insidiano nell’ospite danneggiandolo). Solitamente esiste un equilibrio fra batteri ed ospite, per cui si ha patologia con una differente carica batterica e/o un differente livello di difese immunitarie. Esistono le infezioni esogene, con trasmissione di microrganismi da un individuo infetto ad un altro (tipico dei parassiti obbligati, per cui la semplice presenza porta a patologia) ed esistono le infezioni endogene, con trasmissione di microrganismi da un distretto innocuo ad un patogenico (in tal caso la semplice presenza del batterio non indica lo sviluppo di una infezione).
ADESIVITÀ:
E’ la conseguenza dell’interazione fra recettori ed antirecettori cellula-batterio, che determinano il tropismo del microrganismo; sono meccanismi che offrono dei vantaggi (specificità, elevata affinità per gli oligosaccaridi cellulari), ma anche degli svantaggi (sono dei PAMP, Pathogen Associated Molecular Pattern, poco polimorfi). Le adesine sono molecole batteriche che mediano l’attacco sulle cellule epiteliali (cute e mucose); sono FAA (fimbrial associated adhesin) o NFA (non fimbrial adhesion), mutuamente esclusive; le tossine ciliostatiche sono oligopeptidi che si legano alle ciglia epiteliali, creando asincronia e/o blocco totale delle stesse. La proliferazione cellulare batterica avviene sulla superficie dell’epitelio e molte volte l’azione patogena si esplica con diversi meccanismi: si può avere una elevata antigenicità (che richiama il sistema immunitario), un signaling pro-apoptotico, la presenza di tossine necrotiche e/o un quorum sensing (rilascio di tossine dopo contatto con una certa concentrazione locale di molecole ospite).
INVASIVITÀ:
Alcuni batteri possono avere un differente grado di invasività, altri batteri non sono invasivi; l’invasione solitamente è a carico degli epiteli (intracellulare/intercellulare), con localizzazione locale/sistemica (batteriemia e/o tossiemia); nei tessuti si producono dei siderofori (che competono con la Transferrina), per l’assunzione batterica di ferro. Il potere aggressivo batterico é determinato da aggressine, esotossine ed endotossine. Le aggressine sono in grado di provocare danno anche con una bassa carica virulenta, in grado di attaccare le difese dell’ospite; portano ad una ridotta fagocitosi, una ridotta chemiotassi, un blocco del complemento (come la proteina A stafilcoccica), e tramite catalasi ed altri enzimi litici sono in grado di bloccare la loro digestione. Le esotossine sono componenti proteiche, presenti nei gram positivi/negativi, solitamente termolabili, dotate di elevato potere antigienico. Sono bloccate dalle antitossine (tossoidi), non provocano febbre e sono a localizzazione extracromosomica; per quello che riguarda la loro modalità d’azione possono agire sulla superficie cellulare come la tossina esfoliativa (dello S. aureus), le emolisine e le leucocidine, possono agire con il metodo A-B dove la tossina B lega i recettori cellulari, si modifica e permette l’ingresso della tossina A nella cellula, con citotossicità (tipico di C. difficile), possono essere ADP ribosilanti che modificano il rapporto ATP/ADP agendo sulla adenilato ciclasi (sono soprattutto la tossina colerica, le tossine LT/ST di E. coli e la tossina pertussica), possono essere proteasi intracellulari come metalloproteasi (tossina tetanica e botulinica) oppure sono superantigeni come il TSST (di S. aureus ed enterotossina) o SPE-A (S. pyogenes). Infine le endotossine sono componenti lipoproteiche (LPS), tipiche dei Gram negativi, solitamente termolabili; hanno un buon potere antigenico (anche se inferiore alle esotossine), non esistono tossoidi. Solitamente provocano febbre e sono a localizzazione cromosomica. Il LPS si compone di Lipide A (disaccaride con acidi grassi transmembrana, estremamente tossico), un core di KDO ed eptoso, ed una catena oligosaccaridica (che prende in nome di Ag-O se viene ripetuta linearmente o Ag-R se ramificata). Il LPS può portare a DIC (attivando piastrine e fattori della coagulazione), shock settico (per degranulazione delle mast cells ed attivazione delle anafilotossine), ipoglicemia (per alterazioni metaboliche epatiche) e febbre (per il rilascio di IL1, IL6 e TNF).MRSA:
Lo S. aureus meticillino resistente (MRSA) é stato scoperto nel 1960, solamente dopo un anno dall’introduzione della meticillina nella pratica clinica; è un battere che rapidamente acquisisce resistenza polimicrobica. Esistono nazioni come i Paesi Bassi dove l’incidenza è bassissima grazie ad un adeguato controllo infettivologico, all'isolamento preventivo, allo screening generale, alla politica antibiotica rigorosa, ecc… Esistono ICU dove - proprio grazie all'utilizzo di metodiche di isolamento preventivo e screening a 360° le colonizzazioni e le infezioni da MRSA iniziano ad essere sotto controllo per quello che riguarda il tasso di incidenza d'infezione.
Le principali opzioni di trattamento delle infezioni da MRSA nei pazienti critici includono i glicopeptidi (come la vancomicina e la teicoplanina), il Linezolid e la daptomicina (quest'ultima controindicata per il trattamento della polmonite a causa della sua inattivazione da parte del tensioattivo). Agenti anti-MRSA alternativi sono la Tigeciclina, per i quali c'è un avviso di regolamentazione in merito ad eventuali piccoli aumenti inspiegabile di mortalità, la telavancina, che appare controindicata nei pazienti con insufficienza renale, ed altri come il Ceftaroline, la Dalbavancina e l'Oritavancin, che ad oggi sono limitati in caso di infezioni molto gravi o da germi XDR. Di contro gli Staphylococcus coagulasi negativi sono tipologie di Staphylococcus incapaci di coagulare il plasma, meno patogeni rispetto a S. aureus; generalmente esistono 15 sottospecie e possono essere commensali cutanei, da cui deriva un 19% delle infezioni in ICU (38% nelle PICU). Molti di questi (90%) sono resistenti alla meticillina ed agli aminoglicosidi, ma sono generalmente meno patogeni e virulenti rispetto a MRSA.
ENTEROCOCCUS SPP:
Gli Enterococcus sono cocchi gram positivi che fanno parte della normale flora intestinale e le due forme più frequenti sono l’E. fecalis (generalmente multi-sensibile) e l’E. faecium (generalmente resistente a diversi antibiotici, in particolare al Tazobac). Una buona terapia empirica a priori é tramite l’uso di Vancomicina. L’acquisizione del gene VanA determina però la resistenza alla Vancomicina così come l’utilizzo di Vancomicina a dosi non efficaci, di Cefalosporine e di Metronidazolo sono fattori di rischio per la pressione selettiva di crescita di tali ceppi.
PSEUDOMONAS SPP:
E’ un germe che raramente genera patologia negli individui sani, ma che può provocare sepsi e shock settico in ogni paziente immunocompromesso; sapendo che il 10% dei pazienti è cronicamente colonizzato nell’intestino, P. aeruginosa rapidamente colonizza i pazienti ospedalizzati, arrivando al 25% nella prima settimana ed al 60% dopo due settimane di degenza in ICU. Il germe è intrinsecamente resistente a diversi antibiotici per la presenza di pompe d’efflusso multi-farmaci, ad una membrana impermeabile ed alla produzione di una B-lattamasi. Gli antibiotici che a priori possono agire sul germe sono combinazioni di penicilline (Piperacillina-Tazobactam), Carbapenemici (Imipenem, Meropenem), Cefalosporine (Ceftazidime, Cefepime), Fluorochinolinici (ma sviluppa resistenza), aminoglicosidi ed Aztreonam. Un 10% dei batteri può sviluppare resistenza a tali antibiotici, per cui spesso è consigliata una terapia di combinazione. Uno studio recente (Int Care Med 2013) ha mostrato come la scelta della terapia antibiotica empirica sbagliata sia il fattore di rischio principale per un outcome pessimo ed una maggiore degenza in ICU. Purtroppo non essendo subito disponibile l’antibiogramma è importante conoscere i dati epidemiologici degli P aeruginosa che sono presenti nel territorio.
P. aeruginosa, insieme a E. coli, K. pneumoniae, e A. baumannii, è un patogeno leader nella terapia intensiva, causando gravi infezioni, con una mortalità direttamente connessa con qualsiasi ritardo nell'inizio di una terapia antibiotica appropriata. Nel 2011, elevate percentuali di P. aeruginosa resistenti agli aminoglicosidi, alla ceftazidima, ai fluorochinoloni, alla piperacillina/tazobactam ed ai carbapenemi sono stati segnalati da diversi paesi soprattutto in Europa meridionale e orientale. La resistenza ai carbapenemi si é dimostrata superiore al 10% in 19 dei 29 paesi dichiaranti al Centro europeo per il controllo delle malattie Control (ECDC). Forme di P. aeruginosa resistenti ai carbapenemici ora rappresentano circa il 20% degli isolati in unità di terapia intensiva, con pochi ceppi (ma già attorno al 2-3%) resistenti anche alla Colistina.
Un antibiotico beta-lattamico con attività anti-pseudomonas è generalmente preferito e somministrato con un'infusione prolungato dopo una terapia di carico per raggiungere rapidamente il bersaglio farmacologico; anche se non ci sono prove a sostegno chiaro il vantaggio di una terapia di combinazione (cioè un b-lattamico più un aminoglicoside o un fluorochinolone) rispetto alla monoterapia, molti medici adottano questo regime per infezioni gravi (come in caso di batteriemia o di VAP) e nei pazienti con sepsi grave e shock settico. Quando una terapia di combinazione con un aminoglicoside (amikacina o gentamicina) è preferito, si consiglia una durata massima di 5 giorni.
Per l'infezione causata da un ceppo suscettibile solo di colistina, si raccomanda un regime di colistina alte dosi (9 MU di dose di carico, quindi 4,5 MU due volte al giorno); la somministrazione di colistina nebulizzata è anche considerata per le VAP ed è necessaria una somministrazione intratecale per la meningite. Il vantaggio di aggiungere un carbapenemico alla colistina è chiaro, e diversi esperti preferiscono usare una combinazione che mostra attività sinergica ''in vitro''. I nuovi farmaci con attività contro P. aeruginosa includono ceftazidime/avibactam, un inibitore non-lattamico di classe A e C e la combinazione del nuovo ceftolozane cefalosporina con tazobactam, che mostra l'attività anche contro ceppi MDR e XDR.
S. MALTOPHILA:
Nonostante il germe sia stato inizialmente classificato come con poca virulenza, nel tempo si è sviluppata una multiresistenza, una difficoltà di eradicazione e la comparsa di infezioni opportunistiche in pazienti immunocompromessi. Generalmente si riscontra in caso di VAP (si veda il capitolo apposito, Capitolo 6.1.2) oppure infezioni di siti chirurgici ed infezioni ematogene a partenza dai cateteri. Come detto il germe è difficile da eradicare e la terapia di prima linea è tramite Cotrimoxazolo (come prima scelta) oppure Tircacillina-Clavulanato (come seconda scelta).
ACINETOBACTER SPP:
A. baumanii è un coccobacillo gram-negativo che fa parte della normale flora cutanea, presente in circa il 25% della popolazione; è un organismo persistente nell’ambiente e che può provocare diverse infezioni nosocomiali come polmoniti, infezioni ematogene da cateteri, infezioni delle vie urinarie, meningiti, ecc…Si tratta di un germe intrinsecamente resistente a molti antibiotici come le cefalosporine, le penicilline, i fluorochinolonici e gli aminoglicosidi; generalmente si tratta con l’Imipenem la cui resistenza è rara, oppure in alternativa con Ampicillina-Sulbactam. A. baumannii ha acquisito sempre maggiore attenzione a causa del suo potenziale di causare infezioni gravi e la sua capacità di sviluppare resistenza a praticamente tutti i antimicrobici disponibili. Impostare precocemente una terapia empirica adeguata in caso di infezioni gravi causate da A. baumannii è cruciale in termini di sopravvivenza.
Il trattamento empirico per A. baumannii rappresenta spesso una sfida e dovrebbe essere presa in considerazione in caso di sepsi severa/shock settico e nei centri con più del 25% di prevalenza di A. baumannii multiresistenti; tradizionalmente, i carbapenemi sono stati il farmaco di scelta e sono ancora gli antimicrobici preferiti per le infezioni da Acinetobacter nelle aree con alti tassi di suscettibilità. Il Sulbactam, come detto, è un battericida nei confronti di A. baumannii e rappresenta una valida alternativa per gli A. baumannii sensibili a questo agente. Purtroppo, è stato osservato un costante aumento della resistenza a Sulbactam in A. baumannii. Al giorno d'oggi, le polimixine sono gli antimicrobici con il massimo livello di attività in vitro contro A. baumannii; tuttavia, il loro uso indiscriminato può contribuire allo sviluppo di un’ulteriore selezione di resistenza e può anche esporre i pazienti a tossicità inutili. La Colistina è il più ampiamente utilizzato nella pratica clinica sebbene la polimixina B sembra essere associato con meno tossicità renale; la Tigeciclina, attiva in vitro contro una vasta gamma di bacilli Gram-negativi tra cui A. baumannii, è approvata in Europa per il trattamento di complicate infezioni della cute e delle infezioni intra-addominali. Tuttavia, anche se diverse meta-analisi hanno messo in guardia circa l'aumento del rischio di morte nei pazienti trattati tigeciclina rispetto ad altri antibiotici particolarmente in HAP e VAP, un regime ad alto dosaggio, di solito in combinazione con un altro antimicrobico, può essere un valida alternativa per le infezioni gravi, tra cui le polmoniti da A. baumannii.
BATTERI ESBL:
I batteri ESBL sono batteri che hanno enzimi che conferiscono resistenza a molti beta-lattamici (comprese penicilline, cefalosporine e l'Aztreonam); la presenza di ESBL si associa ad un outcome peggiorativo. I batteri ESBL sono presenti ovunque e vengono ben trattati con Carbapenemici. Come dice il nome (Extended-Spectrum Beta-Lactamase) hanno uno spettro di inibizione verso le B-lattamasi molto più alto rispetto a quello standard. Le famiglie dei batteri con enzima ESBL sono estremamente eterogenee, generalmente sono gram-negativi quali: K. pneumoniae, K. oxytoca, E. coli, Acinetobacter, Enterobacter, Proteus, Pseudomonas, Salmonella, Shigella, Serratia, dcc… I fattori di rischio per la colonizzazione da ESBL sono la lunghezza della degenza in ospedale/ICU, la presenza di CVC, chirurgia addominale d'urgenza, la presenza di PEG/PEJ, la pregressa somministrazione di antibiotici, la pregressa degenza in strutture ospedalizzate, la severità della patologia, la ventilazione meccanica e/o l’emodialisi.
Si pensa che una delle sedi più frequenti di reservoir sia il tratto digestivo (seguito da quello cutaneo) e che la trasmissione avvenga per contatto; il riscontro di batteri con ESBL è andato aumentando sia per una maggiore sensibilità nella ricerca di questi batteri che per le modifiche eseguite nella detezione (secondo EUCAST sono stati modificati i cut-off nelle MIC, rendendo intermedi/resistenti batteri prima considerati sensibili). La terapia di base è tramite carbapenemici (Imipenem, Meropenem, Ertapenem), ma non esistono studi clinici randomizzati per valutare la migliore terapia verso le infezioni ESBL, anche perche molti report presentano una casistica molto ristretta. In caso di polmonite da K. pneumoniae la scelta del carbapenemico riduce significativamente la mortalità; la scelta fra Imipenem e Meropenem si basa solamente sul profilo di tossicità del farmaco (soprattutto effetti pro-epilettogeni per l'Imipenem, mentre il Meropenem è più maneggevole in caso di insufficienza renale). L'Ertapenem offre il vantaggio di una sola somministrazione ed essendo relativamente più recente ci sono studi clinici in continuo rilascio per quello che riguarda la farmacovigilanza stadio IV. La durata della terapia generalmente non è indicata dalla presenza di ESBL, ma è specifica per la sede e la gravità della patologia stessa. Per quello che riguarda il controllo epidemiologico i due meccanismi sono quello di istituire un isolamento da contatto per il paziente e di restringere l'utilizzo di beta-lattamici nel reparto.
Le infezioni causate da batteri ESBL sono difficili da trattare a causa della resistenza dei microrganismi a molti antibiotici; dal 2010 EUCAST e CLSI raccomandano l'uso di alternative ai carbapenemi per il trattamento di questi organismi. Infatti sulla base di test di sensibilità agli antibiotici, alcuni inibitori b-lattamici ed alcune cefalosporine specifiche di quarta generazione (come il cefepime) con una maggiore stabilità contro b-lattamasi potrebbero essere teoricamente utilizzati per trattare le infezioni ESBL. Per quanto ne sappiamo, non sono stati valutati questi ''alternative'' a carbapenemi nei pazienti critici. Al di fuori della ICU, i dati sono ancora scarsi e contraddittori. Secondo tutti i dati più recenti, per i pazienti in condizioni critiche carbapenemi sono ancora preferibili come terapia empirica ad alternative quando si sospetta un’infezione da ESBL. Alternative come terapia definitiva potrebbe essere possibile una volta suscettibilità sono noti. Tuttavia, dosi elevate e amministrazione semi-continuo di b-lattamici dovrebbero essere preferiti.
ENTEROBATTERI RESISTENTI AI CARBAPENEMICI (CRE):
La stragrande maggioranza degli isolati CRE sono resistenti alle classi comunemente utilizzati di antibiotici, a parte la Colistina, la Tigeciclina e la Gentamicina come i principali approcci terapeutici; diversi studi hanno comunque rivelato un alto rischio di mortalità associato a queste infezioni. Data la mancanza di dati provenienti da studi clinici randomizzati, approcci terapeutici nelle infezioni CRE sono basate sull'esperienza clinica accumulate e soprattutto dalle infezioni di K. pneumoniae che produttori di KPC. Recenti evidenze supportano il trattamento di combinazione contenenti due o tre farmaci attivi, rivelando notevoli vantaggi rispetto alle monoterapie in termini di sopravvivenza. Anche se sembra paradossale, il miglioramento della sopravvivenza sembra essere ottenuta quando la combinazione include comunque un carbapenemico, fornendo notevole beneficio di sopravvivenza nei pazienti più gravemente malati e/o con shock settico. Anche combinazioni contenenti aminoglicosidi, in particolare la gentamicina, sono stati associati con esiti favorevoli rispetto ad altre combinazioni e potrebbe servire come in vista di una riduzione dei tassi di resistenza alla colistina.
La Colistina e la Tigeciclina rappresentano gli agenti rimanenti da selezionare per la terapia di combinazione, in base alle caratteristiche di sensibilità a priori; un successo clinico recentemente riportato del 55% nel trattamento delle infezioni da XDR e PDR patogeni con combinazioni di Fosfomicina fanno di essa un altro candidato terapeutico, in particolare nel trattamento delle Enterobacteriaceae contro cui i tassi di suscettibilità sono promettenti. L’uso di dosi elevate (fino a 24 g die) e di terapie di combinazione sono fortemente raccomandati nella cornice di pazienti critici con patogeni MDR. Combinazioni doppie di carbapenemi, costituito da Ertapenem come substrato e Doripenem o Meropenem come il principio attivo, sono stati recentemente dimostrate con successo in serie di piccoli casi e piccoli studi, anche quando l'agente patogeno esprimeva un’elevata MIC ai carbapenemi. Infine, le decisioni relative alla terapia antibiotica empirica dei pazienti critici devono essere basate su una buona conoscenza della distribuzione locale di agenti patogeni e sull'analisi di presenza di fattori di rischio per l'infezione causata da CRE.
(continua...)
REFERENCES:
1. Luyt CE, Brechot N, Trouillet JL, Chastre J. Antibiotic stewardship in the intensive care unit. Crit Care 2014;18:480
2. Kaki R, Elligsen M, Walker S, Simor A, Palmay L, Daneman N. Impact of antimicrobial stewardship in critical care: a systematic review. J Antimicrob Chemother 2011;66:1223–1230
3. Chalfine A, Kitzis MD, Bezie Y, Benali A, Perniceni L, Nguyen JC, Dumay MF, Gonot J, Rejasse G, Goldstein F, Carlet J, Misset B. Ten-year decrease of acquired methicillin-resistant Staphylococcus aureus (MRSA) bacteremia at a single institution: the result of a multifaceted program combining cross-transmission prevention and antimicrobial stewardship. Antimicrob Resist Infect Control 2012;1:18
4. Garnacho-Montero J, Gutierrez- Pizarraya A, Escoresca-Ortega A et al. De-escalation of empirical therapy is associated with lower mortality in patients with severe sepsis and septic shock. Intensive Care Med 2013;39:2237
5. Kumar A, Roberts D, Wood KE et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006;34:1589–1596
6. Tabah A, Koulenti D, Laupland K et al. Characteristics and determinants of outcome of hospital-acquired bloodstream infections in intensive care units: the EUROBACT International Cohort Study. Intensive Care Med 2012;38:1930–1945
7. Ferrer R, Artigas A, Suarez D, Palencia E, Levy MM, Arenzana A, Perez XL, Sirvent JM. Effectiveness of treatments for severe sepsis: a prospective, multicenter, observational study. Am J Respir Crit Care Med 2009;180:861–866
8. Kumar A, Ellis P, Arabi Y, Roberts D et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest 2009;136:1237–1248
9. Zilberberg MD, Shorr AF, Micek ST, Vazquez-Guillamet C, Kollef MH. Multi-drug resistance, inappropriate initial antibiotic therapy and mortality in Gram-negative severe sepsis and septic shock: a retrospective cohort study. Crit Care 2014;18(6):596
10. Aliberti S, Cilloniz C, Chalmers JD et al. Multidrug-resistant pathogens in hospitalised patients coming from the community with pneumonia: a European perspective. Thorax 2013;68:997–999
11. Kollef MH, Sherman G, Ward S et al. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest 1999;115:462–474
12. Goncalves-Pereira J, Pereira JM, Ribeiro O, Baptista JP, Froes F, Paiva JA. Impact of infection on admission and of process of care on mortality of patients admitted to the intensive care unit: the INFAUCI study. Clin Microbiol Infect 2014; doi: 10.1111/1469-0691.12738
13. Prkno A, Wacker C, Brunkhorst FM, Schlattmann P. Procalcitonin-guided therapy in intensive care unit patients with severe sepsis and septic shock—a systematic review and meta-analysis. Crit Care 2013;17(6):R291
14. Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and meta-analysis of randomised trials. BMJ 2004;328(7441):668
15. Heyland DK, Dodek P, Muscedere J, Day A, Cook D, Canadian Critical Care Trials Group. Randomized trial of combination versus monotherapy for the empiric treatment of suspected ventilator-associated pneumonia. Crit Care Med 2008;36(3):737–744
16. Brunkhorst FM, Oppert M, Marx G, Bloos F, Ludewig K, Putensen C, Nierhaus A, Jaschinski U, Meier- Hellmann A, Weyland A, Grundling M, Moerer O, Riessen R, Seibel A, Ragaller M, Buchler MW, John S, Bach F, Spies C, Reill L, Fritz H, Kiehntopf M, Kuhnt E, Bogatsch H, Engel C, Loeffler M, Kollef MH, Reinhart K, Welte T. German Study Group Competence Network Sepsis (SepNet). Effect of empirical treatment with moxifloxacin and meropenem vs meropenem on sepsis-related organ dysfunction in patients with severe sepsis: a randomized trial. JAMA 2012;307(22):2390–2399
17. Micek ST, Welch EC, Khan J, Pervez M, Doherty JA, Reichley RM, Kollef MH. Empiric combination antibiotic therapy is associated with improved outcome against sepsis due to Gram-negative bacteria: a retrospective analysis. Antimicrob Agents Chemother 2010;54(5):1742–1748













0 Response to "Controllo e prevenzione infettiva - Ecologia microbiologica (Capitolo 6.3.2)"
Posting Komentar