
Dopo che abbiamo trattato degli elementi fisiologici e fisiopatologici essenziali riguardanti tutta la piccola circolazione (ventricolo destro, resistenze vascolari polmonari, pressioni vascolari polmonari e pressioni capillari polmonari) ci soffermiamo su una condizione clinica estremamente frequente e che vede la modifica di numerose alterazioni fisiologiche già precedentemente descritte. Parlare di embolia polmonare é un capitolo vastissimo e su cui esistono numerosi scritti, pertanto ci concentreremo su quelli che sono gli elementi pratici essenziali. In questo capitolo accenneremo alla trombosi venosa profonda per poi meglio concentrarci sull'embolia polmonare nel prossimo capitolo (si veda il capitolo dedicato, Capitolo 2.9.4b). Per trombosi venosa profonda (TVP) si intende una condizione clinico-patologica caratterizzata da un evento biologico e fisico-chimico complesso che porta ad una ostruzione di uno/più tronchi dell’asse venoso profondo per la comparsa di fenomeni coagulatori intravascolari.
EPIDEMIOLOGIA:
La TVP é una patologia molto frequente, con tassi d'incidenza che arrivano al 30-50% dei pazienti post-operatori, a seconda della tipologia di chirurgia, gravata inoltre da un elevato rischio di mortalità, rappresentando la terza causa di morte nei pazienti ricoverati oltre i 65 anni d'età e che si manifesta soprattutto agli arti inferiori. La malattia presenza un'incidenza media attorno a 1,92 casi/1.000 persone annue, con maggiori rischi negli uomini e con nell'età avanzata; spesso si associa a patologie sottostanti (nel 52% dei soggetti totali) quali neoplasie (48%), ospedalizzazioni (52%), chirurgia (42%) e traumi maggiori (6%).
Per quello che riguarda la sede della comparsa di trombosi, il processo trombotico si classifica in prossimale o distale in base al coinvolgimento dei distretti venosi in rapporto all’articolazione del ginocchio. Si parla di TVP distale quando si hanno delle trombosi nelle vene del polpaccio e/o nella vena poplitea (al di sotto del ginocchio), clinicamente meno grave e con un tasso di complicanze più basso; dopo l’anticoagulazione è importante rivalutare a 7-10 giorni che non sia evoluta verso una forma di TVP prossimale. Di contro si parla di TVP prossimale quando si ha una trombosi delle vene al di sopra del ginocchio; clinicamente appare importante perché si associa fino al 50% di embolie polmonari clinicamente evidenti, con un tasso di mortalità decisamente maggiore.
EZIOPATOGENESI:
Molto spesso non esiste una chiara causa evidente, anche se probabilmente si ha una modificazione nell’equilibrio nella triade di Virchow (lesione endoteliale, stasi venosa, diatesi trombofilica). Certamente esistono delle sedi anatomiche pericolose a livello dell’arto inferiore, dove è più probabile avere lo sviluppo di una trombosi venosa profonda, per una maggiore compressione estrinseca, soprattutto a livello del cavo popliteo, del canale di Hunter, dell'arcata inguinale e dell'anello del soleo.
Una normale emostasi é necessaria affinché al danno endoteliale sopperiscano le piastrine ed i fattori della coagulazione per tamponare l'emorragia e ristabilire la corretta integrità vascolare; la trombosi é un evento critico sia sul versante arterioso che venoso associato ad un aumento del rischio di morbilità e mortalità. L'integrità dell'endotelio é uno dei fattori cruciali per evitare l'attivazione della coagulazione, dato che l'endotelio contiene tre elementi tromboregolatori quali l'ossido nitrico, le prostacicline e l'ectonucleotidasi CD39 che insieme agiscono nell'evitare la formazione del trombo. La presenza nella matrice extracellulare sottostante del collagene e del fattore tissutale (TF) facilita di contro la formazione e l'attivazione della coagulazione; quando l'endotelio viene danneggiato e/o eliminato, si ha il contatto del sangue con i due elementi pro-trombotici che attivano e promuovono l'attivazione della coagulazione e delle piastrine, oltre all'attivazione della trombina (dei meccanismi base della coagulazione ne parleremo nei capitoli dedicati alla coagulazione, si veda tutto il capitolo dedicato, Capitolo 2.10a).
È stato dimostrato che sia l'attivazione delle piastrine che l'attivazione della trombina sono due elementi contemporanei che nascono dall'esposizione del collagene e del TF, anche se a volte prevale uno o l'altro dei due meccanismi. Le piastrine vengono attivate tramite alcune glicoproteine (in particolare la VI e la II) che a contatto con il collagene portano ad esposizione del vWF piastrinico e la trombina viene attivata (dal TF e dal collagene) ed a sua volta agisce sulle piastrine facilitando la degranulazione delle stesse e favorendo la coagulazione. Diversi esperimenti in vitro hanno mostrato come sia l'una che l'altra via da sole sono in grado di attivare in maniera adeguata la coagulazione, pertanto non é chiaro perché esista un completo overlap fra i due percorsi.
FISIOPATOLOGIA:
Nella fase iniziale la patologia spesso inizia dalle tasche valvolari delle piccole dilatazioni sacciformi localizzate vicino alla parete vascolare, che difatti sono ricche di globuli rossi e fibrina; la venostasi e forse un danno endoteliale locale favorisce la formazione del trombo che si accresce con un progressivo accumulo di piastrine, dirigendosi verso il letto circolatorio. Nella fase evolutiva una volta superato il margine valvolare ha inizio la stratificazione trombotica, con un andamento longitudinale/circonferenziale di espansione del trombo, che può portare ad una occlusione luminale anche totale.
È da notare come il trombo fresco sia una struttura trombotica adesa alla parete venosa solamente nel punto d’origine; il trombo è difatti fluttuante nel lume, con ancora un elevato rischio di embolizzazione a livello polmonare. Di contro, nella maturazione verso il trombo avanzato si ha una retrazione del coagulo (che appare compatto e poco friabile) con fibrosi e neovascolarizzazione e conseguente ricanalizzazione locale. È da notare come una certa quota di trombolisi avviene in maniera spontanea nel 20-30% delle situazioni, durante le prime fasi di formazione del trombo, dato che il nostro organismo prevede un meccanismo di fibrinolisi volto a limitare e contrastare l'estensione della fibrosi.
Un dato molto interessante da notare (anche se ha poca correlazione con il capitolo attuale) é che é stato scoperto come nei capillari cerebrali, la formazione e l'arrivo di piccoli trombi provochi una particolare reazione da parte delle cellule endoteliali locali (non é chiaro se questo possa avvenire anche in altri siti) che tramite alcuni recettori di superficie e canali chimici porta alla fagocitosi del trombo, alla sua riduzione in piccole parti ed alla sua espulsione nello spazio subendoteliale (spazi di Virchow-Robin) in modo tale che le metalloproteasi e la microglia possa distruggere tale materiale, anche se questo genera l'attivazione di una infiammazione locale. Per quanto poco attinente con il problema di cui stiamo trattando, é interessante notare come sempre più l'endotelio si scopra avere un ruolo attivo sia a livello metabolico che nella anti-coagulazione.
Nella fase iniziale la patologia spesso inizia dalle tasche valvolari delle piccole dilatazioni sacciformi localizzate vicino alla parete vascolare, che difatti sono ricche di globuli rossi e fibrina; la venostasi e forse un danno endoteliale locale favorisce la formazione del trombo che si accresce con un progressivo accumulo di piastrine, dirigendosi verso il letto circolatorio. Nella fase evolutiva una volta superato il margine valvolare ha inizio la stratificazione trombotica, con un andamento longitudinale/circonferenziale di espansione del trombo, che può portare ad una occlusione luminale anche totale.
È da notare come il trombo fresco sia una struttura trombotica adesa alla parete venosa solamente nel punto d’origine; il trombo è difatti fluttuante nel lume, con ancora un elevato rischio di embolizzazione a livello polmonare. Di contro, nella maturazione verso il trombo avanzato si ha una retrazione del coagulo (che appare compatto e poco friabile) con fibrosi e neovascolarizzazione e conseguente ricanalizzazione locale. È da notare come una certa quota di trombolisi avviene in maniera spontanea nel 20-30% delle situazioni, durante le prime fasi di formazione del trombo, dato che il nostro organismo prevede un meccanismo di fibrinolisi volto a limitare e contrastare l'estensione della fibrosi.
Un dato molto interessante da notare (anche se ha poca correlazione con il capitolo attuale) é che é stato scoperto come nei capillari cerebrali, la formazione e l'arrivo di piccoli trombi provochi una particolare reazione da parte delle cellule endoteliali locali (non é chiaro se questo possa avvenire anche in altri siti) che tramite alcuni recettori di superficie e canali chimici porta alla fagocitosi del trombo, alla sua riduzione in piccole parti ed alla sua espulsione nello spazio subendoteliale (spazi di Virchow-Robin) in modo tale che le metalloproteasi e la microglia possa distruggere tale materiale, anche se questo genera l'attivazione di una infiammazione locale. Per quanto poco attinente con il problema di cui stiamo trattando, é interessante notare come sempre più l'endotelio si scopra avere un ruolo attivo sia a livello metabolico che nella anti-coagulazione.
CLINICA:
La sintomatologia clinica è estremamente varia fra paziente e paziente ed anche nello stesso paziente, manifestandosi da forme asintomatiche fino a forme con gravi complicanze come l’embolia polmonare e/o la phlegmasia cerulea dolens.
Nella forma classica il dolore è il primo sintomo del paziente, generalmente accentuato in ortostasi e che regredisce in clinostasi; viene esacerbato dal movimento e/o da alcune manovre semeiologiche (di cui abbiamo già parlato nell'Esame Obiettivo Vascolare, si veda il Capitolo 2.0.1). In alcune situazioni può essere palpabile un cordone duro a decorso lineare, che corrisponde alla vena trombizzata. Il segno di Homans si ha quando la dorsiflessione forzata del piede, a ginocchio esteso, per uno stiramento muscolare locale, genera vivo dolore nella muscolatura; il segno di Bauer si ha quando la compressione delle masse surali sulla membrana interossea evoca un dolore molto intenso. L'edema e la cianosi possono essere importanti e localizzate ad un arto. In Medicina Intensiva spesso sono minime e presentano numerose patologie in diagnostica differenziale.
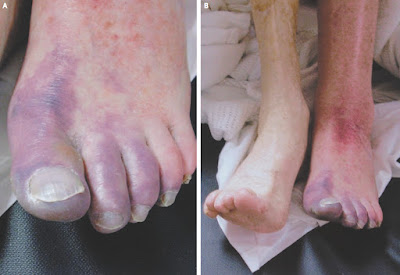
Nelle forme severe si può avere la presenza di uno o più di questi segni che indicano generalmente un processo trombotico venoso di grado severo; la sensibilità clinica non è elevatissima, ma presenta una buona specificità. Nel segno di Pratt si ha un turgore particolare a livello delle vene pretibiali, con incremento della temperatura cutanea, eritema e tensione locale. Il segno di Lourel presenta un dolore spontaneo alla manovra del Valsalva, mentre il segno di Lisker mostra dolore intenso alla percussione tibiale. Nel caso di tromboflebite settica si ha la clinica classica a livello locale (spesso molto intensa) con associata ad iperpiressia, brividi, tachicardia e compromissione dello stato generale del paziente. La phlegmasia cerulea dolens è una complicanza seria, legata ad una estesa trombizzazione del letto venoso profondo, con una conseguente insufficienza arteriosa acuta. Si ha edema intenso, cianosi marcata, assenza dei polsi, ipotensione dell’arto e dolore acuto locale, che nel tempo possono portare a collasso circolatorio e shock.
Nella forma classica il dolore è il primo sintomo del paziente, generalmente accentuato in ortostasi e che regredisce in clinostasi; viene esacerbato dal movimento e/o da alcune manovre semeiologiche (di cui abbiamo già parlato nell'Esame Obiettivo Vascolare, si veda il Capitolo 2.0.1). In alcune situazioni può essere palpabile un cordone duro a decorso lineare, che corrisponde alla vena trombizzata. Il segno di Homans si ha quando la dorsiflessione forzata del piede, a ginocchio esteso, per uno stiramento muscolare locale, genera vivo dolore nella muscolatura; il segno di Bauer si ha quando la compressione delle masse surali sulla membrana interossea evoca un dolore molto intenso. L'edema e la cianosi possono essere importanti e localizzate ad un arto. In Medicina Intensiva spesso sono minime e presentano numerose patologie in diagnostica differenziale.
Nelle forme severe si può avere la presenza di uno o più di questi segni che indicano generalmente un processo trombotico venoso di grado severo; la sensibilità clinica non è elevatissima, ma presenta una buona specificità. Nel segno di Pratt si ha un turgore particolare a livello delle vene pretibiali, con incremento della temperatura cutanea, eritema e tensione locale. Il segno di Lourel presenta un dolore spontaneo alla manovra del Valsalva, mentre il segno di Lisker mostra dolore intenso alla percussione tibiale. Nel caso di tromboflebite settica si ha la clinica classica a livello locale (spesso molto intensa) con associata ad iperpiressia, brividi, tachicardia e compromissione dello stato generale del paziente. La phlegmasia cerulea dolens è una complicanza seria, legata ad una estesa trombizzazione del letto venoso profondo, con una conseguente insufficienza arteriosa acuta. Si ha edema intenso, cianosi marcata, assenza dei polsi, ipotensione dell’arto e dolore acuto locale, che nel tempo possono portare a collasso circolatorio e shock.
Esistono diverse metodiche che permettono di porre la diagnosi di trombosi venosa profonda, anche se generalmente è l’assieme della clinica, del laboratorio e dell’imaging che pone la diagnosi di certezza. Data la non totale sensibilità e specificità delle diverse tecniche (dalla clinica all’imaging al laboratorio) è estremamente importante eseguire una stratificazione del rischio pre-test per il paziente di avere la trombosi venosa profonda. Fra gli score più utilizzati c’è il Wells score che prende in considerazione 9 differenti variabili cliniche, permettendo di stratificare i pazienti in basso, medio ed alto rischio di TVP. Si parla di alta probabilità quando si ha un punteggio pari/superiore a 3, di media probabilità quando si hanno 1-2 punti e bassa probabilità quando si hanno 0 punti; la presenza di una pregressa TVP è un altro punto che è stato aggiunto successivamente e che rientra nei criteri di Wells modificati.
LABORATORIO:
I D-Dimeri sono i prodotti della degradazione della fibrina stabilizzata, che possono trovarsi in circolazione per molte cause; dopo che la fibrina si attiva e si lega al coagulo, il fattore XIII permette la stabilizzazione ulteriore della fibrina da maglie lineari ad una maglia bidimensionale. La limitazione della trombosi é assicurata dalla fibrinolisi, di cui uno dei meccanismi chiave é la protesi della fibrina polimerizzata, che prende il nome di D-dimero. La detezione del D-dimero é un esame ad elevata sensibilità diagnostica, ma di scarsa specificità per la presenza di numerosi falsi positivi (in particolare di molti stati infiammatori, in caso di neoplasie, per età superiori ad 80 anni, in caso di gravidanza, in caso di dissezione aortica, ecc…); il suo valore predittivo negativo è elevato (94%), ma non assoluto. A differenza dell’embolia polmonare, in caso di negatività non permette di escludere totalmente la patologia va difatti associato alla clinica: una bassa probabilità pre-test associata a valori negativi possono escludere la malattia, ma un'alta probabilità pre-test con D-dimeri nei limiti non escludono totalmente una TVP.
I D-Dimeri sono i prodotti della degradazione della fibrina stabilizzata, che possono trovarsi in circolazione per molte cause; dopo che la fibrina si attiva e si lega al coagulo, il fattore XIII permette la stabilizzazione ulteriore della fibrina da maglie lineari ad una maglia bidimensionale. La limitazione della trombosi é assicurata dalla fibrinolisi, di cui uno dei meccanismi chiave é la protesi della fibrina polimerizzata, che prende il nome di D-dimero. La detezione del D-dimero é un esame ad elevata sensibilità diagnostica, ma di scarsa specificità per la presenza di numerosi falsi positivi (in particolare di molti stati infiammatori, in caso di neoplasie, per età superiori ad 80 anni, in caso di gravidanza, in caso di dissezione aortica, ecc…); il suo valore predittivo negativo è elevato (94%), ma non assoluto. A differenza dell’embolia polmonare, in caso di negatività non permette di escludere totalmente la patologia va difatti associato alla clinica: una bassa probabilità pre-test associata a valori negativi possono escludere la malattia, ma un'alta probabilità pre-test con D-dimeri nei limiti non escludono totalmente una TVP.
DIAGNOSI DIFFERENZIALE:
Nonostante l’approccio al paziente con trombosi venosa profonda possa essere suggestivo per tale condizione patologica, è sempre utile valutare la possibile presenza di una diagnostica differenziale di altra origine quale un dolore muscolare post-stress, un edema con/su paralisi dell’arto, linfangiti e/o ostruzioni linfatiche, insufficienza venosa cronica, cisti di Baker (soprattutto se rotta), cellulite, patologie a carico del compartimento del ginocchio, ecc... Va sempre presa in considerazione la diagnostica differenziale in questi pazienti, dato fra tutti i pazienti in cui si sospetta una trombosi venosa profonda solo il 17-32% di essi presenta tale manifestazione clinica e richiede un trattamento anticoagulante (da ricordare che è un trattamento non privo di rischi).
Nonostante l’approccio al paziente con trombosi venosa profonda possa essere suggestivo per tale condizione patologica, è sempre utile valutare la possibile presenza di una diagnostica differenziale di altra origine quale un dolore muscolare post-stress, un edema con/su paralisi dell’arto, linfangiti e/o ostruzioni linfatiche, insufficienza venosa cronica, cisti di Baker (soprattutto se rotta), cellulite, patologie a carico del compartimento del ginocchio, ecc... Va sempre presa in considerazione la diagnostica differenziale in questi pazienti, dato fra tutti i pazienti in cui si sospetta una trombosi venosa profonda solo il 17-32% di essi presenta tale manifestazione clinica e richiede un trattamento anticoagulante (da ricordare che è un trattamento non privo di rischi).
(continua...)
REFERENCES:
1. Stein PD. Pulmonary Embolism. Second edition. Pulmonary Embolism and Deep Venous Thrombosis at Autopsy. Oxford, UK: Blackwell Publishing Co; 2007:3-15.
2. Kistner RL, Ball JJ, Nordyke RA, Freeman GC. Incidence of pulmonary embolism in the course of thrombophlebitis of the lower extremities. Am J Surg. 1972;124:169-176.
3. Browse NL, Clemenson G, Croft DN. Fibrinogen-detectable thrombosis in the legs and pulmonary embolism. Br Med J. 1974;1:603-604.
4. Roberts HC, Kauczor HU, Schweden F, Thelen M. Spiral CT of pulmonary hypertension and chronic thromboembolism. J Thorac Imaging. 1997;12:118-127.
5. Meignan M, Rosso J, Gauthier H, et al. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med. 2000;160:159-164.
6. Monreal M, Ruiz J, Fraile M, et al. Prospective study on the usefulness of lung scan in patients with deep vein thrombosis of the lower limbs. Thromb Haemost. 2001;85:771-774.
7. Girard P, Mathieu M, Simonneau G, et al. Recurrence of pulmonary embolism during anticoagulant treatment: a prospective study. Thorax 1987;42:481-486.
8. Moser KM, Fedullo PF, LitteJohn JK, Crawford R. Frequent asymptomatic pulmonary embolism in patients with deep venous thrombosis. JAMA. 1994;271:223-225.
9. Kalodiki E, Domjan J, Nicolaides AN, et al. V/Q defects and deep venous thrombosis following total hip replacement. Clin Radiol. 1995;50:400-403.
10. Martin F, Leroyer C, Oger E, et al. Pulmonary embolism and the level of thrombosis. A prospective study of 155 patients. Rev Mal Respir. 1995;12:465-469.
11. Lusiani L, Visonà A, Bonanome A, et al. The characteristics of the thrombi of the lower limbs, as detected by ultrasonic scanning, do not predict pulmonary embolism. Chest. 1996;110:996-1000.
12. Decousus H, Leizorovicz A, Parent F, et al. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d’Embolie Pulmonaire par Interruption Cave Study Group. N Engl J Med. 1998;338:409-415.
13. Paul JF, Hernigou A, Beyssen B, et al. Systematic screening of pulmonary embolism with spiral CT scanner in patients with proximal deep vein thrombosis. Presse Med. 1999;28:633.
14. Girard P, Decousus M, Laporte S, et al; PREPIC Study Group. Diagnosis of pulmonary embolism in patients with proximal deep vein thrombosis: specificity of symptoms and perfusion defects at baseline and during anticoagulant therapy. Am J Respir Crit Care Med. 2001; 164:1033-1037.
15. López-Beret P, Pinto JM, Romero A, et al. Systematic study of occult pulmonary thromboembolism in patients with deep venous thrombosis. J Vasc Surg. 2001;33:515-521.
16. Monreal M, Büller H, Lensing AW, et al. Should patients with deep vein thrombosis alone be treated as those with concomitant asymptomatic pulmonary embolism? A prospective study. Thromb Haemost. 2002;88:938-942.
17. Jiménez D, Díaz G, Marín E, et al. The risk of recurrent venous thromboembolism in patients with unprovoked symptomatic deep vein thrombosis and asymptomatic pulmonary embolism. Thromb Haemost. 2006;95:562-566.
18. Mostbeck A, Partsch H, Köhn H, König B. Pulmonary embolism in leg and pelvic vein thrombosis. Results of a prospective study-diagnosis, frequency, nuclear medical and clinical appearance. Wien Klin Wochenschr. 1980;92:464-471.
19. Plate G, Ohlin P, Eklöf B. Pulmonary embolism in acute iliofemoral venous thrombosis. Br J Surg. 1985;72:912-915.
20. Dorfman GS, Cronan JJ, Tupper TB, et al. Occult pulmonary embolism: a common occurrence in deep venous thrombosis. AJR Am J Roentgenol. 1987;148:263-266.
21. Huisman MV, Büller HR, ten Cate JW, et al. Unexpected high prevalence of silent pulmonary embolism in patients with deep venous thrombosis. Chest. 1989;95:498-502.
22. Cuppini S, Cattelan AM, Casara D, Prandoni P. Occult pulmonary embolism in patients with proximal deep venous thrombosis. 1991;6:1-5
23. Hirsch JF, Demilly P. Screening of asymptomatic pulmonary embolisms by systematic scintigraphy in apparently uncomplicated phlebitis. Ann Med Interne (Paris). 1991;142:168-170.
24. Partsch H, Oburger K, Mostbeck A, et al. Frequency of pulmonary embolism in ambulant patients with pelvic vein thrombosis: a prospective study. J Vasc Surg. 1992;16:715-722.
25. Monreal M, Ruíz J, Olazabal A, et al. Deep venous thrombosis and the risk of pulmonary embolism. A systematic study. Chest. 1992;102:677-681.
26. Nielsen HK, Husted SE, Krusell LR, et al. Silent pulmonary embolism in patients with deep venous thrombosis. Incidence and fate in a randomized controlled trial of anticoagulation versus no anticoagulation. J Intern Med. 1994;235:457-461.
27. Tomkowski W, Borowiec B, Burakowski J, et al. Clinically silent pulmonary embolism in patients with proximal deep venous thrombosis. Pneumonol Alergol Pol. 1996;64(Suppl 2):166-2168.
28. Venosi S, Zamboni V, Irace L, et al. Efficacy of an intravenous low-molecular-weight dermatan sulphate (Desmin) in patients with acute proximal deep venous thrombosis and silent pulmonary embolism. A pilot study. J Int Med Res. 1997;25:98-107.
29. Schellong SM, Schwarz T, Kropp J, et al. Bed rest in deep vein thrombosis and the incidence of scintigraphic pulmonary embolism.Thromb Haemost. 1999;82(Suppl 1):127-129.
30. Partsch H. Therapy of deep vein thrombosis with low molecular weight heparin, leg compression and immediate ambulation. Vasa. 2001;30:195-204.
1. Stein PD. Pulmonary Embolism. Second edition. Pulmonary Embolism and Deep Venous Thrombosis at Autopsy. Oxford, UK: Blackwell Publishing Co; 2007:3-15.
2. Kistner RL, Ball JJ, Nordyke RA, Freeman GC. Incidence of pulmonary embolism in the course of thrombophlebitis of the lower extremities. Am J Surg. 1972;124:169-176.
3. Browse NL, Clemenson G, Croft DN. Fibrinogen-detectable thrombosis in the legs and pulmonary embolism. Br Med J. 1974;1:603-604.
4. Roberts HC, Kauczor HU, Schweden F, Thelen M. Spiral CT of pulmonary hypertension and chronic thromboembolism. J Thorac Imaging. 1997;12:118-127.
5. Meignan M, Rosso J, Gauthier H, et al. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis. Arch Intern Med. 2000;160:159-164.
6. Monreal M, Ruiz J, Fraile M, et al. Prospective study on the usefulness of lung scan in patients with deep vein thrombosis of the lower limbs. Thromb Haemost. 2001;85:771-774.
7. Girard P, Mathieu M, Simonneau G, et al. Recurrence of pulmonary embolism during anticoagulant treatment: a prospective study. Thorax 1987;42:481-486.
8. Moser KM, Fedullo PF, LitteJohn JK, Crawford R. Frequent asymptomatic pulmonary embolism in patients with deep venous thrombosis. JAMA. 1994;271:223-225.
9. Kalodiki E, Domjan J, Nicolaides AN, et al. V/Q defects and deep venous thrombosis following total hip replacement. Clin Radiol. 1995;50:400-403.
10. Martin F, Leroyer C, Oger E, et al. Pulmonary embolism and the level of thrombosis. A prospective study of 155 patients. Rev Mal Respir. 1995;12:465-469.
11. Lusiani L, Visonà A, Bonanome A, et al. The characteristics of the thrombi of the lower limbs, as detected by ultrasonic scanning, do not predict pulmonary embolism. Chest. 1996;110:996-1000.
12. Decousus H, Leizorovicz A, Parent F, et al. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prévention du Risque d’Embolie Pulmonaire par Interruption Cave Study Group. N Engl J Med. 1998;338:409-415.
13. Paul JF, Hernigou A, Beyssen B, et al. Systematic screening of pulmonary embolism with spiral CT scanner in patients with proximal deep vein thrombosis. Presse Med. 1999;28:633.
14. Girard P, Decousus M, Laporte S, et al; PREPIC Study Group. Diagnosis of pulmonary embolism in patients with proximal deep vein thrombosis: specificity of symptoms and perfusion defects at baseline and during anticoagulant therapy. Am J Respir Crit Care Med. 2001; 164:1033-1037.
15. López-Beret P, Pinto JM, Romero A, et al. Systematic study of occult pulmonary thromboembolism in patients with deep venous thrombosis. J Vasc Surg. 2001;33:515-521.
16. Monreal M, Büller H, Lensing AW, et al. Should patients with deep vein thrombosis alone be treated as those with concomitant asymptomatic pulmonary embolism? A prospective study. Thromb Haemost. 2002;88:938-942.
17. Jiménez D, Díaz G, Marín E, et al. The risk of recurrent venous thromboembolism in patients with unprovoked symptomatic deep vein thrombosis and asymptomatic pulmonary embolism. Thromb Haemost. 2006;95:562-566.
18. Mostbeck A, Partsch H, Köhn H, König B. Pulmonary embolism in leg and pelvic vein thrombosis. Results of a prospective study-diagnosis, frequency, nuclear medical and clinical appearance. Wien Klin Wochenschr. 1980;92:464-471.
19. Plate G, Ohlin P, Eklöf B. Pulmonary embolism in acute iliofemoral venous thrombosis. Br J Surg. 1985;72:912-915.
20. Dorfman GS, Cronan JJ, Tupper TB, et al. Occult pulmonary embolism: a common occurrence in deep venous thrombosis. AJR Am J Roentgenol. 1987;148:263-266.
21. Huisman MV, Büller HR, ten Cate JW, et al. Unexpected high prevalence of silent pulmonary embolism in patients with deep venous thrombosis. Chest. 1989;95:498-502.
22. Cuppini S, Cattelan AM, Casara D, Prandoni P. Occult pulmonary embolism in patients with proximal deep venous thrombosis. 1991;6:1-5
23. Hirsch JF, Demilly P. Screening of asymptomatic pulmonary embolisms by systematic scintigraphy in apparently uncomplicated phlebitis. Ann Med Interne (Paris). 1991;142:168-170.
24. Partsch H, Oburger K, Mostbeck A, et al. Frequency of pulmonary embolism in ambulant patients with pelvic vein thrombosis: a prospective study. J Vasc Surg. 1992;16:715-722.
25. Monreal M, Ruíz J, Olazabal A, et al. Deep venous thrombosis and the risk of pulmonary embolism. A systematic study. Chest. 1992;102:677-681.
26. Nielsen HK, Husted SE, Krusell LR, et al. Silent pulmonary embolism in patients with deep venous thrombosis. Incidence and fate in a randomized controlled trial of anticoagulation versus no anticoagulation. J Intern Med. 1994;235:457-461.
27. Tomkowski W, Borowiec B, Burakowski J, et al. Clinically silent pulmonary embolism in patients with proximal deep venous thrombosis. Pneumonol Alergol Pol. 1996;64(Suppl 2):166-2168.
28. Venosi S, Zamboni V, Irace L, et al. Efficacy of an intravenous low-molecular-weight dermatan sulphate (Desmin) in patients with acute proximal deep venous thrombosis and silent pulmonary embolism. A pilot study. J Int Med Res. 1997;25:98-107.
29. Schellong SM, Schwarz T, Kropp J, et al. Bed rest in deep vein thrombosis and the incidence of scintigraphic pulmonary embolism.Thromb Haemost. 1999;82(Suppl 1):127-129.
30. Partsch H. Therapy of deep vein thrombosis with low molecular weight heparin, leg compression and immediate ambulation. Vasa. 2001;30:195-204.











0 Response to "Embolia polmonare - Trombosi Venosa Profonda (Capitolo 2.9.4a)"
Posting Komentar