Con il termine PEEP si intende la pressione di fine espirazione che viene applicata al paziente quando viene ventilato mediante un supporto meccanico invasivo o non invasivo. Generalmente la pressione di fine espirazione in un polmone sano é pari a 0 cmH2O, ma quando viene applicata una PEEP, tale pressione viene aumentata; la PEEP generalmente viene usata quando si hanno alcuni problemi specifici al polmone (vedi oltre), che comportano un collasso degli alveoli e delle vie aeree periferiche.
L’applicazione di una PEEP su un ventilatore fa si che la valvola espiratoria del ventilatore si chiuda quando la pressione espiratoria cade al di sotto del livello prefissato; la chiusura di tale valvola, mantiene un volume (quindi una pressione) nelle vie aeree che permette di mantenere aperte le vie aeree stesse. Esistono due tipologie di meccanismi: a flusso o a soglia. La PEEP a flusso viene generata tramite un resistore a flusso che genera tale pressione creando una resistenza al flusso odi gas tramite un orifizio; come il diametro dell’orifizio aumenta in dimensioni, il livello di pressione applicato si riduce e viceversa. Anche cambi nel flusso di gas espirato posso modificare la PEEP, in quanto maggiore é il flusso d’aria espirato, maggiore sarà la pressione espiratoria generata. Le maschere con PEEP si basano su questo meccanismo. La PEEP a soglia utilizza un resistore a soglia che somministra una pressione costante durante tutta l’espirazione indipendentemente dal flusso di gas espirato (é flusso-indipendente). Quando si utilizza questo meccanismo, l’aria esalata procede senza problemi fino a quando la pressione cade al di sotto dei valori di PEEP pre-stabiliti. In questo caso, il gas espiratorio blocca il flusso ed il sistema mantiene la pressione desiderata. La PEEP di molti ventilatori presenta un resistore di questo tipo.
La PEEP viene facilmente applicata con tutti i devices di ventilazione invasiva e non invasiva; i pazienti che sono ventilati con maschera sono generalmente svegli, attenti ed orientati, in grado di proteggere le proprie vie aeree e che mantengono dei normali valori di pCO2 grazie alla normale attività ventilatoria. L’uso della PEEP é soprattutto per aumentare il reclutamento alveolare, migliorare il rapporto pO2/FiO2 e migliorare l’attività del sistema cardiovascolare. I pazienti che sono ventilati con un CPAP nasale (soprattutto i neonati che respirano obbligatoriamente con il naso) beneficiano dello stesso meccanismo. In entrambi in casi (naso o bocca), i problemi dell’uso indiscriminato della PEEP (soprattutto ad alti valori) é la distensione gastrica, lo sviluppo di necrosi da pressione, edema della mucosa nasale ed abrasione del faringe posteriore. Anche in caso di tubi endotracheali (o tracheotomie) viene spesso erogata una PEEP, di cui generalmente 3-5 cmH2O sono necessari per vincere le resistenze dei devices invasivi.
EFFETTI RESPIRATORI:
La PEEP é l’applicazione di una pressione costante al circuito del ventilatore e del paziente ad esso collegato; la PEEP deve essere intesa come una manovra terapeutica, e come tale ha delle indicazioni e delle controindicazioni, quest’ultime da tenere bene a mente in quanto possono provocare dei danni anche fatali per ogni paziente, in particolare il paziente con forte instabilità emodinamica e/o danni respiratori severi.
INDICAZIONI ALLA PEEP:
Gli scopi della somministrazione della PEEP sono quelli di favorire l’ossigenazione nei tessuti periferici, mantenere una pO2 superiore a 8 kPa ed una SpO2 superiore al 90%, reclutare gli alveoli e mantenerci areati e ristabilire un’adeguata capacità funzionale residua. Favorire l’uso di adeguati livelli di PEEP, inoltre, permette di ridurre le concentrazioni di FiO2, evitando i danni tossici generati dai radicali liberi dell’ossigeno (che generalmente si hanno per concentrazioni superiori al 60%). Le indicazioni in senso stretto per l’uso della PEEP sono:
- infiltrati bilaterali alla radiografia del torace
- atelettasie ricorrenti con bassa capacità funzionale residua
- riduzione della compliance polmonare
- pO2 inferiore a 8 kPa o FiO2 superiore al 60%
- ARDS con rapporto pO2/FiO2 inferiore a 18
- ipossia refrattaria
Nonostante queste siano le indicazioni ufficiali, giova però di più ricordarsi degli effetti respiratori ed emodinamici che sono collegati alla PEEP. Dato che uno degli elementi chiave é quello di trasformare la clinica nei suoi elementi fisiopatologici, per poter instaurare una terapia basata sulla fisiopatologia, appare più utile identificare gli effetti fisiologici della PEEP per poter facilmente determinare se sia necessario o meno implementarla nella terapia.
Per quello che concerne le tipologie di PEEP, si parla di PEEP minima (o bassa PEEP) quando si somministrano bassi valori di PEEP (generalmente attorno a 3-5 cmH2O) per aiutare il paziente a mantenere una normale capacità funzionale residua, condizione che si riduce eccessivamente quando il paziente é intubato ed allettato (soprattutto per la riduzione della compliance toracica e la compressione addominale). Applicando tali livelli di pressione, si garantisce in condizioni standard una normale capacità funzionale residua. Si parla invece di PEEP terapeutica quando i valori superano i 5 cmH2O e viene utilizzata per la terapia degli elementi che abbiamo segnalato poc’anzi. Vedremo fra poco come il concetto di migliore PEEP sia un concetto dinamico, che si deve adeguare alle condizioni respiratorie ed emodinamiche del paziente per quello specifico momento. In particolare, quando si hanno pazienti complessi, con valori di PEEP superiori a 10 cmH2O, può essere utile fare uno studio per ottimizzare la PEEP, tenendo conto di diversi parametri quali:
- un’ossigenazione con pO2 superiore a 8 kPa e FiO2 inferiore al 40% (SpO2 90-97%)
- un’ottimo trasporto di ossigeno (circa 1000 ml/min di ossigeno)
- la minima compromissione emodinamica (in termini di pressione arteriosa e gittata cardiaca)
- la migliore compliance polmonare
- un rapporto pO2/FiO2 superiore a 27
- la minima differenza fra la pCO2 e l’etCO2
- i migliori valori di SvO2
In particolare la pressione arteriosa e la gittata cardiaca, se eccessivamente ridotti, possono significare dei valori eccessivi di PEEP in rapporto all’attività cardiovascolare (tenendo conto che, come vedremo, ci sono in gioco diversi fattori), ma anche il gradiente pCO2 - etCO2. Se é vero che con l’aumentare del reclutamento alveolare, si ha una riduzione del gradiente, quando si ha un’eccessiva distensione alveolare, si ottiene una riduzione della gittata cardiaca, pertanto il gradiente pCO2-etCO2 inizia ad aumentare, pur mantenendo l’onda espiratoria con un angolo alfa attorno ai 90°.
CONTROINDICAZIONI ALLA PEEP:
L’applicazione della PEEP può essere pericolosa per i suoi effetti emodinamici (vedi oltre), soprattutto in caso di instabilità emodinamica o disfunzione ventricolare destra (vedi oltre), così come in caso di ipovolemia non controllata (emorragia attiva, disidratazione severa, ipovolemia relativa su capillary-leak, ecc…). Una controindicazione assoluta per l’applicazione della PEEP é la presenza di uno pneumotorace significativo (o addirittura sotto pressione), così come in caso di qualsiasi situazione di baro/volotrauma o di fistola esofago-bronchiale. Nei pazienti con incremento della ICP l’applicazione delle PEEP può incrementare ulteriormente le pressioni intra-craniche per un aumento della PVC e quindi riduzione del ritorno venoso cerebrale; diversi studi hanno dimostrato la non utilità di ventilare questi pazienti preventivamente con un incremento della PEEP, ma di applicare una PEEP qualora si sviluppi ipossiemia (una delle cause principali di morte in questa popolazione di pazienti), misurando attentamente le ICP.
Gli effetti benefici del reclutamento alveolare si ha quando all’applicazione della PEEP si assiste ad un aumento della capacità funzionale residua (FRC), mentre tali effetti benefici non si hanno per pazienti che presentano una iperinflazione (come in caso di enfisema): aree già iper-distese possono ulteriormente distendersi, aumentando la compressione dei capillari alveolari ed incrementando ulteriormente i valori di pressione arteriosa polmonare (PAPs).
Infine la PEEP può avere degli effetti imprevedibili e negativi nei pazienti che presentano delle alterazioni nella distribuzione del sangue e nella ventilazione, come in caso di polmonite monolaterale, embolia polmonare (anche per ragioni emodinamiche), atelettasia polmonare unilaterale, ecc… In caso quindi di patologia monolaterale, appare generalmente meglio utilizzare un tubo doppio-lume per una ventilazione selettiva unilaterale.
EFFETTI POLMONARI:
La gran parte degli studi sulla PEEP sono ad oggi applicati alle situazioni di ARDS, condizione che ha permesso di comprendere meglio gli effetti respiratori polmonari dell’applicazione della PEEP ad un polmone. Con l’applicazione della PEEP a livelli incrementali, si ha un reclutamento progressivo degli alveoli polmonari (si veda oltre la curva PV per maggiori dettagli) altrimenti collassati, soprattutto a livello basale. A livello ventrale, dove gli alveoli sono già aperti, si assiste ad un effetto nullo, con un semplice aumento dell’espansione alveolare già pre-esistente.
Con un ulteriore incremento della PEEP si assiste ad un over-stretching delle unità alveolari, con riduzione della compliance alveolare locale e conseguente riduzione del Volume Corrente in questa unità alveolare (si ha una “ventilazione” quando l’alveolo modifica nel tempo i propri volumi, mentre a volumi quasi costanti per pressioni elevate, si vene a perdere l’effetto ventilatorio). Generalmente con l’incremento dei valori di PEEP verso valori definiti come “alti” (generalmente 30 cmH2O, ma tali valori possono essere misurati e determinati per ogni paziente tramite l’uso di una sonda esofagea, si veda oltre) si assiste appunto a tali effetti polmonari negativi. Lo stesso overstretching si può avere nelle zone polmonari intermedie, in maniera progressiva con l’incremento progressivo dei valori di PEEP. Appare pertanto importantissimo comprendere che con l’aumento dei valori di PEEP si assiste a due meccanismi esattamente opposti: da un lato, con l’incremento dei valori di PEEP le unità alveolari chiuse (generalmente a livello basale) vengono reclutate, ma allo stesso tempo le unità alveolari già aperte e con pressioni interne aumentate (come può avvenire a livello apicale o ancora più in caso di ostruzioni dinamiche all’efflusso) possono subire un overstretching e ridurre la loro ventilazione. In altre parole, la curva statica PV (si veda oltre per la descrizione) é differente per alcune unità alveolari e - soprattutto - le differenti unità alveolari localizzate in aree anatomiche differenti (basali, medie, apicali) si trovano su punti differenti della curva statica PV.
Appare pertanto fondamentale saper registrare le curve PV per ogni paziente ventilato, soprattuto in situazioni estreme o delicate, e registrare i parametri respiratori ed emodinamici a determinati valori di PEEP (0, 5, 10, 15, ecc… per fare un esempio), valutando a quali valori di PEEP si ottengono i migliori risultati ventilatori per il paziente.
CURVA PRESSIONE-VOLUME:
La curva statica pressione-volume (Static Pressure-Volume, SPV) é una curva che può essere utilizzata in clinica per determinare il migliore livello di PEEP per il paziente, in particolari in situazioni di ventilazione difficile, come in caso di ARDS. I fattori che determinano la forma della curva (che generalmente é di tipo sigmoide) sono le singole curve PV di ogni unità alveolare, il cambiamento di dimensioni dei dotti alveolari e delle dimensioni delle vie aeree e le forze elastiche del parenchima polmonare e della parete toracica quando il polmone ha un determinato volume d’aria al suo interno.
In clinica la curva statica PV permette di identificare il Lower Inflection Point (LIP), alle volte chiamato PFLEX, l’Upper Inflection Point (UIP) e la pendenza fra questi due punti, che rappresenta la compliance del sistema, inteso come capacità delle unità alveolari di essere reclutate durante la manovra inspiratoria. Il LIP é il primo punto dove la pendenza della curva cambia in maniera significativa (non sempre può essere identificato nei pazienti); inizialmente si pensava rappresentasse il punto in cui si aprivano la gran parte degli alveoli, mentre più recentemente si é compreso che gli alveoli continuano ad essere reclutati in maniera progressiva ed il LIP rappresenta dove le condizioni statiche del polmone (elencate poc’anzi) influenzano il comportamento polmonare nella distendibilità alveolare. Il LIP rappresenta il punto dove il numero di alveoli reclutati per un determinato aumento di PEEP, aumenta in maniera significativa. Generalmete in caso di ARDS (si veda l’apposito capitolo, Capitolo 3.4.3), la PEEP viene impostata a 2-4 cmH2O oltre il LIP. Alti valori di PEEP sono inutili (perché arrivati all’UIP, all’aumentare della PEEP non si assiste ad un maggiore reclutamento degli alveoli) per non dire dannosi, date le importanti interazioni emodinamiche che intercorrono tra la PEEP ed il sistema cardiovascolare (si veda oltre).
Le teorie correnti suggeriscono che sia estremamente importante impostare la PEEP fra i due punti di flessione della curva stessa; valori di PEEP inferiori al LIP risultano inutili e non benefici per il sistema respiratorio ed anche emodinamico (atelettasie polmonari importanti si associano a compressioni vascolari con incremento delle resistenze vascolari polmonari e conseguente aumento delle pressioni in arteria polmonare); valori di PEEP superiori all’UIP sono estremamente pericolosi per la forte instabilità emodinamica che generano (si veda oltre) e per l’alto rischio di baro/volotrauma polmonare. Appare pertanto strategico utilizzare protocolli prestabiliti per poter determinare la curva statica PV ed adeguatamente impostare la PEEP. Esistono numerose tecniche (ed altrettante varianti per ogni tecnica), ma qui ne citiamo principalmente 3:
- Tecnica della siringa: é un metodo che viene eseguito su un paziente ventilato invasivamente, con un pallone endotracheale adeguatamente inflato (per evitare perdite d’aria) ed una siringa calibrata di 3 litri d’aria che viene attaccata al sistema respiratorio del paziente; alla siringa é attaccato un manometro di precisione. Il paziente, curarizzato, viene messo in respirazione spontanea. Si insufflano progressivamente 50-100 ml d’aria e - dopo aver raggiunto l’equilibrio pressorio (la PPLAT) si misurano i valori di pressione registrati. Si continua così fino al raggiungimento di un target (generalmente 40-45 cmH2O) e si plottano i risultati su un grafico, che rappresenta la curva statica PV del paziente in quel determinato momento clinico. Lo svantaggio é che per tutto il tempo dell’esame il paziente non respira e può mostrare aggregazioni nella propria ipossiemia, ipercapnia e - ad alte pressioni intratoraciche - divenire instabile emodinamicamente.
- Tecnica dell’occlusione respiratoria: questa tecnica, chiamata anche metodo dell’occlusione multipla viene eseguita mentre il paziente é connesso al ventilatore. La procedura viene eseguita interrompendo regolarmente i respiri del paziente con periodi di respiri a differenti volumi polmonari (viene anche misurata l’autoPEEP dopo ogni cambiamento, in modo da essere sicuri che ogni cambio in volume a fine espirazione siano stabili). Durante i respiri-test, si valutano i punti su una curva PV usando la manovra di occlusione di fine inspirazione (per 3 secondi); a seguire si riprende la respirazione “standard” per 4 respiri, prima di impostare un nuovo respiro-test. La sequenza dei respiri-test può essere fatto con volumi differenti, ma in maniera randomizzata.
- Tecnica basso flusso (quasi-statica): questa tecnica, chiamata anche tecnica “a flusso costante” cerca di determinare la curva PV statica utilizzando un singolo respiro somministrando aria/ossigeno a 2 l/min fino a quando la pressione non raggiunge 45 cmH2O. Si parla anche di “curva PV quasi-statica” dato che il flusso é lento, ma non viene interrotto per la misura, per cui non si hanno periodi di no-flow. Anche in questo caso il paziente deve essere sedato e paralizzato. I risultati sono generalmente simili a quelli ottenuti con il metodo della siringa, ma generalmente viene preferito quando si hanno pazienti ventilati con una lunga fase inspiratoria ed un ventilatore che possa mostrare in diretta la curva PV. Generalmente non é facile registrare la curva di deflazione; inoltre, se si utilizza un metodo “intermedio” a 9 l/min, si ha un leggero shift della curva verso destra. Ad oggi, alcuni software presenti nei nuovi ventilatori permettono di eseguire una curva PV quasi-statica (come l’Hamilton Galileo), con conseguente misurazioni del LIP e dell’UIP.
- Curva PV dinamica: la curva PV dinamica si ottiene durante la fase respiratoria con flusso di gas; generalmente é possibile visualizzarla sul monitor mentre al paziente viene somministrato il Volume Corrente abituale. Alcuni clinici utilizzano tale curva per determinare il LIP e l’UIP, ma tale curva presenta numerose limitazioni, l’identificazione dei punti non é sempre facile rispetto alle curve statiche ed inoltre la presenza di secrezioni, PEEP basali ed i cambiamenti dinamici di pressioni e volumi possono modificare notevolmente la curva PV da respiro a respiro. Infine, sono necessarie pressioni maggiori per superare le forze viscoelastiche per aprire gli alveoli durante le misurazioni dinamiche rispetto a quelle statiche. Per tali motivi, la curva PV dinamica non é consigliata per determinare il LIP e l’UIP per settore adeguatamente la PEEP in caso di ventilazioni in situazioni delicate (come in caso di ARDS).
EFFETTI EMODINAMICI:
Un discorso a parte - ed estremamente importante - é rappresentato dagli effetti emodinamici della PEEP, talmente importante che l’uso della PEEP (e l’adattamento dei suoi valori) rappresenta uno dei parametri fondamentali da prendere in considerazione quanto si esegue una valutazione emodinamica del paziente in ICU. La maggior parte di tali effetti sono già stati discussi precedentemente (si vedano i capitoli relativi, Capitolo 2.7.2, Capitolo 2.7.4, Capitolo 3.2.2), per cui qua andremo ad analizzarli brevemente, rimandando ulteriori dettagli ai capitoli relativi.
PEEP E CAMERE DESTRE:
Per quello che concerne il precarico ventricolare destro, il ritorno venoso è guidato e determinato da alcune variabili: in condizioni di riposo e steady-state l'atrio destro ha una pressione di circa 0 mmHg (chiamata RAP, Right Atrial Pressure); se impostiamo il discorso dal punto di vista dell'atrio, lo scopo della contrazione cardiaca è quella di eliminare la quantità di fluido che si accumula dentro l'atrio destro, che è associato ad un incremento di pressione locale, per riportarlo alle condizioni basali iniziali con RAP pari a 0 mmHg. La circolazione sistemica ha una pressione intrinseca che è chiamata Pressione di Riempimento Sistemico (PSF, Systemic Filling Pressure) che spinge il sangue dalla circolazione venosa verso il cuore destro per semplice gradiente pressorio. La PSF è in funzione del volume di sangue circolante (maggiore volume significa maggiore PSF) e delle resistenze vascolari che generalmente si oppongono al passaggio di sangue (maggiori resistenze vogliono dire minore apporto di sangue all'atrio destro). La PSF appare essere indipendente dalla gittata cardiaca.
La differenza di pressione che si instaura fra il PSF e l'atrio destro determina la driving force che spinge il sangue dal sistema venoso all'atrio destro (chiaramente a parità di resistenze vascolari venose). Il corpo mantiene i valori di PSF alti a sufficienza per poter avere un flusso di sangue fra il sistema venoso e l'atrio destro stesso; un'equivalenza di pressioni porterebbe ad un gradiente PSF-RAP pari a 0 mmHg, con arresto del ritorno venoso. Si può pertanto dire che la misura chiamata gradiente PSF-RAP sia una misura che parla del gradiente pressorio che esiste fra il sistema venoso e l'atrio destro.
Il concetto che abbiamo visto poc'anzi può essere rappresentato nel grafico seguente; sull'asse delle ascisse è segnala la RAP (in mmHg), mentre sull'asse delle ordinate il ritorno venoso (l/min); alcuni studi degli anni '60 hanno dimostrato come la PSF nella popolazione in media si attesti attorno ad un valore di 7 mmHg; pertanto si può vedere come la curva di base trovi un flusso di ritorno venoso pari a 0 l/min quando la RAP è pari alla PSF (perché il gradiente PSF-RAP va a 0). Questa curva, che si mantiene costante con la riduzione della RAP (e quindi con l'aumentare del gradiente), va a plateau quando la RAP arriva al valore di 0 mmHg, in quanto si assiste ad un collasso delle strutture venose, con limitazione al flusso. L’applicazione della PEEP, pertanto, comporta un aumento delle pressioni intratoraciche, con conseguente aumento della RAP e conseguente riduzione del ritorno venoso al ventricolo destro.
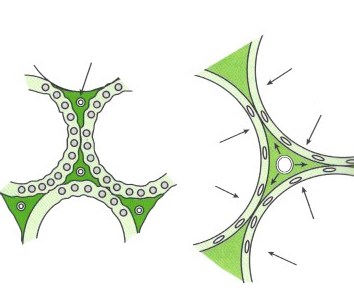
Per quello che invece concerne il post-carico ventricolare destro, il sistema vascolare polmonare presenta anche dei vasi che sono distendibili per cui all’aumentare delle pressioni alveolari (generalmente tramite applicazione di pressioni di ventilazione positive), si ha un aumento dello stiramento vascolare, con riduzione del diametro dei piccoli vasi e conseguente aumento delle RVP, secondo quanto indicato in figura. Si veda come tale rapporto é di tipo U-shaped, dato che anche pressioni alveolari troppo basse possono portare ad un ripiegamento delle strutture vascolari, con eccessivo kinking e conseguente aumento delle RVP. Se si guarda pertanto al sistema in maniera integrata, si può pensare come a basse pressioni di ventilazione molti vasi polmonari sono chiusi per il loro tono intrinseco e la pressione alveolare é maggiore di questi ed i pochi vasi aperti sono comunque schiacciati. Con l’aumento delle pressioni intratoraciche, i vasi progressivamente chiusi si aprono (reclutamento) ed i vasi schiacciati si dilatato (distensione), spiegando una caduta importante delle resistenze vascolari, così importante da avere un comportamento logaritmico come disegnato in figura.
Pertanto un applicazione della PEEP intratoracica porta ad aumento delle distensioni delle pareti alveolari, con conseguente aumento dello stretching delle pareti dei capillari polmonari (quindi con incremento esponenziale delle resistenze vascolari polmonari, RVP). L’aumento delle RVP, secondo la legge di Bernoulli, appare legato in maniera direttamente proporzionale all’aumento delle pressioni arteriose polmonari (PAPs); pertanto l’applicazione della PEEP comporta un aumento del post-carico ventricolare destro.
Se si plotta su un grafico P-V la compliance delle pareti ventricolari destre, si può facilmente notare come il ventricolo destro sia in grado di aumentare notevolmente i propri volumi senza aumentare in maniera importante le pressioni intracavitarie, mostrando pertanto una maggiore compliance (definita classicamente come dV/dP). Tutto questo è possibile grazie ad un aumento della superficie totale delle pareti ventricolari destre, manifeste macroscopicamente con una dilatazione del ventricolo destro. Se si analizza l'area della superficie totale di ciascun ventricolo e le correliamo con i volumi ventricolari, appare evidente come la dilatazione ventricolare destra corrisponda ad un aumento considerevole del rapporto dV/dA (dove dA è il delta-Area inteso come modifica della superficie ventricolare a contatto con il torrente ematico), conseguentemente con ridotto stretching sulla parete ventricolare destra e pochi cambiamenti nello Stroke Volume (SV). Pertanto un aumento di volume è ben tollerato dal ventricolo destro, con minimo aumento dello stiramento di parete ventricolare e minimo aumento dello Stroke Volume. Ventricoli destri perfettamente funzionanti, sono pertanto in grado di compensare riduzioni anche importanti del ritorno venoso, tramite un effetto-buffer legato all’anatomia ventricolare destra (si veda il capitolo relativo al ventricolo destro, Capitolo 2.9.0).
PEEP E CAMERE SINISTRE:
Abbiamo appena visto come l’incremento della PEEP si rifletta in una riduzione del precarico destro ed un incremento del post carico destro. Tali elementi, anche in un ventricolo destro perfettamente funzionante, comportano una riduzione della gittata destra (riduzione che diviene emodinamicamente significativa per situazioni di disfunzione ventricolare destra importante o per incrementi eccessivi dei valori di PEEP). Essendo i due sistemi cardiaci (destro-sinistro) posizionati “in serie” fra loro, appare evidente come questo si rifletta in una riduzione del precarico sinistro, portando pertanto la PEEP a svolgere un “effetto protettivo” nei confronti del ventricolo sinistro qualora ci siano segni di disfunzione ventricolare sinistra o di sovraccarico.
Per quello che concerne il post-carico sinistro, espresso come la forza che si oppone allo svuotamento del ventricolo sinistro, tale post-carico non deve essere semplicisticamente identificabile nella pressione arteriosa (che rappresenta una delle componenti del post-carico sinistro), ma in differenti fattori quali la pressione arteriosa, la rigidità vascolare (“vascular stiffness”), il couplage ventricolo-arterioso ed infine la pressione trans-toracica. Tale pressione viene a ridursi con l’aumento dei valori pressori di PEEP, facilitando pertanto lo svuotamento ventricolare sinistro. Il concetto può apparire contraddittorio e di difficile comprensione ad un primo momento, pertanto può essere inteso in un’altra maniera: lo svuotamento del ventricolo sinistro viene controbilanciato dalla pressione trans-toracica (pressione esterna - pressione interna al torace) che, schiacciando il torace, rende più difficile lo svuotamento della camera cardiaca sinistra. La presenza di una PEEP comporta un incremento delle pressioni intra-toraciche, controbilanciando la pressione atmosferica e riducendo pertanto l’opposizione allo svuotamento ventricolare sinistro (il post-carico sinistro appunto).
MANOVRE DI RECLUTAMENTO:
Una manovra di reclutamento viene definita come un aumento sostenuto della pressione nel polmone con lo scopo di aprire più unità alveolari collassate possibili. Generalmente viene eseguita (e ci sono numerosi studi scientifici) nei pazienti con ARDS, ma può essere utilizzata anche nei pazienti post-operatori ed in pazienti che presentano atelettasie di diversa origine. il reclutamento coinvolge l’intero polmone, aumentando i suoi volumi dal Volume Residuo fino alla Capacità Polmonare Totale (TLC). Una volta che il polmone viene aperto, le unità alveolari sono mantenute aperte dai valori di PEEP che vengono impostati (soprattutto se superiori al LIP) o, preferibilmente, al di sotto dell’UIP, proteggendo il polmone con valori di pressione inspiratoria inferiori all’UIP stesso. La manovra si compone di tre parti: la prima parte é caratterizzata dall’inflazione per permettere l’apertura degli alveoli (il massimo possibile), la seconda parte é la manovra di deflazione per determinare il punto al quale la maggior parte degli alveoli polmonari inizia a collabire (determinando i punti sulla curva e la PEEP cui impostare la ventilazione); la terza parte é nuovamente l’inflazione per aggiustare il ventilatore ai valori di PEEP pre-impostati.
Come esempio di una manovra di reclutamento (le tecniche le abbiamo descritte prima parlando della curva PV), si guardi la figura seguente: si ha di fronte un paziente sedato, intubato e curarizzato. Viene impostata una pressione di 0 cmH2O ed a questa corrisponde un volume minimo, pari al volume residuo polmonare. Si aumenta la pressione di 4 cmH2O alla volta (in questo caso con la tecnica della siringa) e si registra sul grafico i livello di volume che si trovano per una data pressione: si noti come dai 3 cmH2O si ha un aumento sinigifcativo dei volumi polmonari, a 9 cmH2O il polmone é quasi totalmente disteso ed a 15 cmH2O oramai non si abbia più nessun incremento volumetrico. A questo punto si interrompe la manovra di reclutamento e si passa alla fase di deflazione, riducendo la pressione sempre di 4 cmH2O alla volta, registrando i risultati sul grafico. Si noti l’isteresi (cioé la differenza fra la curva inspiratoria ed espiratoria, generata in gran parte dalla presenza di surfactante polmonare che riduce la tensione superficiale ed in parte anche dalle resistenze bronchiali) ed il fatto che in questo caso dagli 6 cmH2O inizia a perdersi il volume polmonare precedentemente guadagnato. Clinicamente questo si identifica per una riduzione dei valori di PaO2 in maniera importante; generalmente questo é il miglior indicatore clinico ed é meno costoso rispetto ad eseguire un’emogasanalisi ad ogni step. In questo caso, dopo la terza fase di nuovo reclutamento, il polmone viene nuovamente ri-espanso fino alla capacità polmonare totale (TLC) per poi impostare una PEEP attorno a 7-8 cmH2O, così da garantire un’adeguata apertura alveolare polmonare.


L’uso della TC-polmonare ha permesso di identificare gli effetti pan-inspiratori della manovra di reclutamento; la curva sigmoide suggerisce che sono differenti le porzioni polmonari che vengono reclutate di volta in volta ed in effetti l’apertura degli alveoli inizia dalle zone già reclutate (dove é necessaria l’applicazione di minore pressione per aprire gli alveoli) per arrivare infine alle aree completamente atelettasiche, che generalmente sono localizzate a livello basale. L’apertura alveolare avviene nel tempo (non é istantanea) ed ogni unità alveolare ha bisogno del proprio tempo; utilizzando la TC-polmonare generalmente si é visto come 40 secondi sia il tempo massimo affinché tutte le unità alveolari reclutabili ad un determinato livello di pressione siano aperte.
La manovra di reclutamento possiede degli effetti collaterali che, come spiegato nelle sezioni precedenti in merito agli effetti respiratori ed emodinamici sono di due ordini: delle complicanze respiratorie legate all’effetto del baro/volotrauma con rischio di rottura alveolare e pneumotorace (che può portare a forte instabilità emodinamica) o al peggioramento stesso di uno pneumotorace pre-esistente, e complicanze emodinamiche per il forte stress sulle camere cardiache destre legato alla forte riduzione del ritorno venoso ed all’incremento delle pressioni polmonari.
TIPOLOGIA DI MANOVRE:
Ad oggi esistono differenti tipologie di manovre di reclutamento, pubblicate su diversi articoli ed oggetto di discussione nella comunità scientifica. Si parla di metodi meccanici con il ventilatore, metodi manuali al pallone-AMBU, timing differenti, ecc… È da ricordare che, ad oggi, l’esecuzione di manovre di reclutamento si sono dimostrate efficaci nel ridurre l’entità dell’ipossiemia, ma non si sono dimostrate in grado di ridurre la mortalità del paziente.
- Inflazione sostenuta: questa tecnica si ottiene applicando una pressione sostenuta ad alto livello; generalmente il ventilatore é impostato su CPAP-modalità spontanea e la pressione in CPAP é incrementata fino a 30-40 cmH2O per circa 40 secondi. Questo approccio non é comunemente accettato da diversi autori.
- Ventilazione ad elevata PEEP: é una tipologia di manovra dove si utilizza la pressione controllata (generalmente impostata 20 cmH2O oltre la PEEP) e delle frequenze respiratorie attorno a 10-12 atti/min; la PEEP viene progressivamente incrementata in maniera che la massima pressione inspiratoria (PIP) sia inferiore a 40 cmH2O. La massima PEEP che si riesce a raggiungere viene mantenuta per 40-60 secondi e poi ridotta secondo lo schema tradizionale.
- Ventilazione a PEEP incrementale: é una tipologia di manovra che utilizza la pressione controllata, ma la PEEP viene incrementata di 5 cmH2O alla volta; ogni incremento viene mantenuto per qualche minuto (2-5 min), sempre con frequenze respiratorie attorno a 10-12 atti/min, aumentando il tempo inspiratorio (fino a I:E = 1:1).
La manovra di deflazione permette di stabilire il LIP al quale si ha il collasso della gran parte degli alveoli polmonari. Alcuni clinici non utilizzano tale manovra, impostando a priori dei valori di PEEP fra 10-15 cmH2O in maniera arbitraria. Il de-recrutamento generalmente viene eseguito in maniera progressiva (2.5 - 5 cmH2O ogni 5-10 secondi) per valutare la compliance e la saturazione.
Alcune questioni rimangono ancora senza risposta; in caso di ARDS il polmone che appare recrutabile generalmente rappresenta meno del 10% della densità polmonare visibile allo scanner: é realmente utile eseguire una manovra per questo 10%? Il polmone deve necessariamente essere aperto? Alcune unità, anche a valori elevati di PEEP, non si aprono: é sbagliato lasciare queste aree non ventilate? La prevenzione all’atelettasia é necessaria? Diversi studi sono ancora necessari per determinare l’impatto sulla morbilità e sulla mortalità di tale manovra nei diversi contesti clinici, in particolare in caso di ARDS. Nei prossimi capitoli tratteremo anche dell'utilizzo della PEEP (oltre che di diversi elementi del ventilatore) applicata alle differenti situazioni fisiopatologiche.
REFERENCES:
1. Mushin M, Rendell-Baker W, Thompson PW, Mapleson WW: Automatic Ventilation of the Lungs. 1980 Blackwell Oxford p. 62-160
2. American Society for Testing and Materials: Standards specifications for ventilators intended for use in critical care. ASTM Standards 1991;36:1123-1155
3. MacIntyre NR: Principles of mechanical ventilation. Mason R Broaddus V Murray Nadel Textbook of Respiratory Medicine. 5th edition 2010 Elsevier Philadelphia
4. Habashi NM: Other approaches to open-lung ventilation: airway pressure release ventilation. Crit Care Med 2005;33 (3 Suppl):S228-S240
5. Branson RD, MacIntyre NR: Dual control modes of mechanical ventilation. Respir Care. 1996;41:294-305
6. Lellouche F, Brochard L: Advanced closed loops during mechanical ventilation (PAV, NAVA, ASV, SmartCare). Clinical Anaesthesiol 2009;23:81-93
7. Mitrouska J, Xirouchaki N, Patakas D, Siafakas N, Georgopoulos D: Effects of chemical feedback on respiratory motor and ventilatory output during different modes of assisted mechanical ventilation. Eur Respir J 1999;13:873-882
8. Sinderby C, Navalesi P, Beck J, et al.: Neural control of mechanical ventilation in respiratory failure. Nature Med 1999;5:1433-1436
9. Sassoon CSH: Mechanical ventilator design and function: The trigger variable. Respir Care. 1992;37:1056-1069
10. Truwit JD, Marini JJ: Evaluation of thoracic mechanics in the ventilated patient. Part I. Primary measurements. J Crit Care 1988;3:133-150
11. Truwit JD, Marini JJ: Evaluation of thoracic mechanics in the ventilated patient. Part II. Applied mechanics. J Crit Care 1988;3:192-213
12. Ranieri VM, Brienza N, Santostasi S, et al.: Impairment of lung and chest wall mechanics in patients with acute respiratory distress syndrome: role of abdominal distension. Am J Respir Crit Care Med 1997;156:1082-1091
13. Prinianakis G, Kondili E, Georgopoulos D: Patient-ventilator interaction: An overview. Respir Care Clin N Am 2005;11:201-224
14. Marini JJ, Crooke PS: A general mathematical model for respiratory dynamics relevant to the clinical setting. Am Rev Respir Dis 1993;147:14-24
15. Macklen PT: Relationship between lung mechanics and ventilation distribution. Physiology. 1973;16:580-588
16. Milic-Emili J, Henderson JAN, Dolovich MB, et al.: Regional distribution of inhaled gas in the lung. J Appl Physiol 1966;21:749-759
17. Pratt PC: Pathology of the adult respiratory distress syndrome. Thurlbeck WM Ael MR The Lung: Structure, Function and Disease. 1978 Williams & Wilkins Baltimore 43-57
18. Caironi P, Cressoni M, Chiumello D, et al.: Lung opening and closing during ventilation of acute respiratory distress syndrome. Am J Respir Crit Care Med 2010;181:578-586
19. Gattinoni L, Caironi P, Cressoni M, et al.: Lung recruitment in patients with the acute respiratory distress syndrome. New Engl J Med 2006;354:1775-1786
20. Kacmarek RM, Pierson DJ: AARC conference on positive end expiratory pressure. Respir Care. 1988;33:419-527
21. Gattinoni L, Pelosi P, Crotti S, et al.: Effects of positive end expiratory pressure on regional distribution of tidal volume and recruitment in adult respiratory distress syndrome. Am J Respir Crit Care Med 1995;151:1807-1814
22. Webb HH, Tierney DF: Experimental pulmonary edema due to intermittent positive pressure ventilation with high inflation pressures: Protection by positive end-expiratory pressure. Am Rev Respir Dis 1974;110:556-565
23. Wyszogrodski I, Kyei-Aboagye K, Taaeusch HW Jr, Avery ME: Surfactant inactivation by hyper ventilation: Conservation by end-expiratory pressure. J Appl Physiol 1975;38:461-466
24. Grasso S, Stripoli T, De Michele M, et al.: ARDSNet ventilatory protocol and alveolar hyperinflation: role of positive end-expiratory pressure. Am J Resp Crit Care Med 2007;176:761-767 2007
25. Crotti S, Mascheroni D, Caironi P, et al.: Recruitment and derecruitment during acute respiratory failure. Am J Respir Crit Care Med 2001;164:131-140
26. Rimensberger PC, Prisine G, Mullen BM, et al.: Lung recruitment during small tidal volume ventilation allows minimal positive end expiratory pressure without augmenting lung injury. Crit Care Med 1999;27:1940-1945
27. Lim SC, Adams AB, Simonson DA, et al.: Intercomparison of recruitment maneuver efficacy in three models of acute lung injury. Crit Care Med 2004;32:2371-2377
28. Pelosi P, Cadringher P, Bottino N, et al.: Sigh in acute respiratory distress syndrome. Am J Respir Crit Care Med 1999;159:872-880
29. Armstrong BW, MacIntyre NR: Pressure controlled inverse ratio ventilation that avoids air trapping in ARDS. Crit Care Med 1995;23:279-285
30. Cole AGH, Weller SF, Sykes MD: Inverse ratio ventilation compared with PEEP in adult respiratory failure. Intensive Care Med 1984;10:227-232
31. Kacmarek RM, Kirmse M, Nishimura M, Mang H, Kimball WR: The effects of applied vs auto-PEEP on local lung unit pressure and volume in a four-unit lung model. Chest 1995;108:1073-1079
32. Dreyfuss D, Saumon G: Ventilator induced lung injury: Lessons from experimental studies. Am J Respir Crit Care Med 1998;157:294-323
33. Dreyfuss D, Soler P, Bassett G, et al.: High inflation pressure pulmonary edema. Am Rev Respir Dis 1988;137:1159-1164
34. Muscedere JG, Mullen JB, Gan K, Slutsky AS: Tidal ventilation at low airway pressures can augment lung injury. Am J Respir Crit Care Med 1994;149:1327-1334
35. Plotz FB, Slutsky AS, van Vught AJ, Heijnen CJ: Ventilator-induced lung injury and multiple system organ failure: a critical review of facts and hypotheses. Intensive Care Med 2004;30:1865-1872
36. Ranieri VM, Suter PM, Totorella C, et al.: Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome. JAMA 1999;282:54-61
37. Nahum A, Hoyt J, Schmitz L, et al.: Effect of mechanical ventilation strategy on dissemination of intertracheally instilled E. coli in dogs. Crit Care Med 1997;25:1733-1743
38. Hager DN, Krishnan JA, Hayden DL, Brower RG: Tidal volume reduction in patients with acute lung injury when plateau pressures are not high. Am J Respir Crit Care Med 2005;172:1241-1245
39. Benito S, Lemaire F: Pulmonary pressure-volume relationship in acute respiratory distress syndrome in adults: Role of positive and expiratory pressure. J Crit Care 1990;5:27-34
40. Gajic O, Lee J, Doerr CH, et al.: Ventilator-induced cell wounding and repair in the intact lung. Am J Respir Crit Care Med 2003;167:1057-1063
41. Rich BR, Reickert CA, Sawada S, et al.: Effect of rate and inspiratory flow on ventilator induced lung injury. J Trauma 2000;49:903-911
42. Pinsky MR, Guimond JG: The effects of positive end-expiratory pressure on heart-lung interactions. J Crit Care 1991;6:1-15
43. Marini JJ, Culver BH, Butler J: Mechanical effect of lung inflation with positive pressure on cardiac function. Am Rev Respir Dis 1979;124:382-386
44. Lemaire F, Teboul JL, Cinotti L, et al.: Acute left ventricular dysfunction during unsuccessful weaning from mechanical ventilation. Anesthesiology 1988;69:171-179
45. Hughes JM, Glazier JB, Maloney JE, West JB: Effect of lung volume on the distribution of pulmonary blood flow in man. Respir Physiol 1968;4:58-72
46. Thille AW, Rodriguez P, Cabello B, Lellouche F, Brochard L: Patient-ventilator asynchrony during assisted mechanical ventilation. Int Care Med 2006;32:1515-22
47. MacIntyre NR, McConnell R, Cheng KC: Applied PEEP reduces the inspiratory load of intrinsic PEEP during pressure support. Chest 1997;1111:188-193
48. Jenkinson SG: Oxygen toxicity. New Horiz 1993;1:504-511
49. Fagon J, Chastre J, Domart Y, et al.: Nosocomial pneumonia in patients receiving continuous mechanical ventilation. Am Rev Respir Dis 1989;139:877-884
50. Collard HR, Saint S, Matthay MA: Prevention of ventilator-associated pneumonia: an evidence-based systematic review. Ann Intern Med 2003;138:494-501
51. Hager DN, Brower RG: Customizing lung-protective mechanical ventilation strategies. Crit Care Med 2006;34:1554-1555
52. Slutsky AS: ACCP consensus conference: Mechanical ventilation. Chest 1993;104:1833-1859
53. Amato MB, Barbas CSV, Medievos DM, et al.: Effect of a protective ventilation strategy on mortality in ARDS. N Engl J Med 1998;338:347-354
54. Villar J, Kacmarek R, Peres-Mendez L, et al.: A high positive end expiratory pressure low tidal volume strategy improves outcome in persistent ARDS. Crit Care Med 2006;34:1311-1318
55. NIH ARDS Network: Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342:1301-1308
56. Myers T, MacIntyre NR: Does airway pressure release ventilation offer important new advantages in mechanical ventilatory support? Resp Care 2007;52:452-460
57. Putensen C, Bain M, Hormann C: Selecting ventilator settings according to the variables derived from the quasi static pressure volume relationship in patients with acute lung injury. Anesth Analg. 1993;77:436-447
58. Suter PM, Fairley HB, Isenberg MD: Optimal end expiratory pressure in patients with acute pulmonary failure. N Engl J Med 1975;292:284-289
59. Caramez MP, Kacmarek RM, Helmy M, et al.: A comparison of methods to identify open-lung PEEP. Intensive Care Med 2009;35:740-747
60. Grasso S, Terragni P, Mascia L, et al.: Ranieri VM. Airway pressure-time curve profile (stress index) detects tidal recruitment/hyperinflation in experimental acute lung injury. Crit Care Med. 2004;32:1018-1027
61. Phoenix SI, Paravastu S, Columb M, Vincent JL, Nirmalan M: Does a higher positive end expiratory pressure decrease mortality in acute respiratory distress syndrome? A systematic review and meta-analysis. Anesthesiology 2009;110:1098-2005
62. Briel M, Meade M, Mercat A, et al.: Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis. JAMA 2010;303:865-873
63. Reissmann HK, Ranieri VM, Goldberg P, Gottfried SB: Continuous positive airway pressure facilitates spontaneous breathing in weaning chronic obstructive pulmonary disease patients by improving breathing pattern and gas exchange. Intensive Care Med 2000;26:1764-1772
64. McConnell RR: Adjuncts to mechanical ventilation. MacIntyre NR Branson RD Mechanical Ventilation. 2001 WB Saunders Philadelphia 400-414
65. ACCP/AARC/SCCM Task Force: Evidence based guidelines for weaning and discontinuing mechanical ventilatory support. Chest 2001;120: suppl 6
65. ACCP/AARC/SCCM Task Force: Evidence based guidelines for weaning and discontinuing mechanical ventilatory support. Chest 2001;120: suppl 6















0 Response to "PEEP - caratteri generali (Capitolo 3.4.2)"
Posting Komentar