I clostridi (che letteralmente significano fuso) sono batteri anaerobi obbligati, che che fermentano gli zuccheri e che producono energia sotto forma di ATP mediante la fosforilazione dei substrati circostanti. Sono bacilli Gram positivi, sporigeni, anaerobi obbligati, mobili dato che sono dotati di flagelli; molti di essi sono saprofiti o commensali intestinali. Gli antigeni di superficie sono molto simili fra loro; la differenza diagnostica è data dalle flagelline: esistono 4 forme principali nell’uomo di Clostridium spp, che soprattutto sono commensali della flora intestinale (tranne il C. botulinum): Clostridium tetani, Clostridium botulinum, Clostridium perfringens ed il Clostridium difficile.
La relazione fra il battere e l’umano inizialmente si pensava essere semplicemente di commensale, ma nel tempo é divenuto chiaro che C. difficile é uno dei germi patogeni enterici fra i più virulenti ed aggressivi ed in USA é uno dei germi più frequentemente riscontrati nelle infezioni nosocomiali (453.000 casi nel 2011 e 29.000 morti solamente in USA). Oltretutto, i costi legati alla sovrainfezione da C. difficile portano a quadruplicare le spese ospedaliere ed i giorni di degenza. La mortalità globale per l’infezione da C. difficile é attorno al 5%, incidenza che aumenta fino al 15-20% in caso di colite severa, definita come la presenza di leucocitosi marcata (oltre 15.000 cell/ul), ipoalbuminemia, insufficienza renale acuta, ecc…
PATOGENESI:
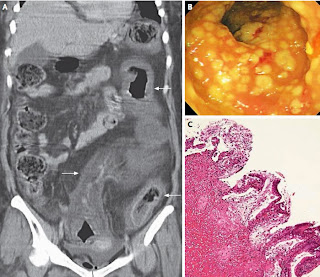
C. difficile colonizza il colon e rilascia due tossine (chiamate TcdA e TcdB) che generano colite nelle persone suscettibili, disattivando alcune GTPasi della famiglia Rho, che portano alla morte delle cellule intestinali, perdita della funzione di barriera ed aumento di infiammazione colica; l’infezione é trasmessa da spore che sono resistenti al caldo, gli acidi ed agli antibiotici e che sono distribuite in gran parte nei terreni ed in piccola quota sulle superfici, sia comunitarie che nosocomiali. La colonizzazione intestinale é prevenuta dalle proprietà del microbioma intestinale, che viene danneggiato dall’utilizzo di antibiotici in grado di eliminare gran parte della flora intestinale; anche l’età avanzata, la chemioterapia e le malattie croniche debilitanti contribuiscono ad aumentarne la suscettibilità. Le manifestazioni cliniche non sono sempre evidenti.
Il germe é raramente invasivo e la tossicità é generata dalle due tossine che risultano pericolose per l’integrità della mucosa colica; sul perché alcuni pazienti sviluppino sintomi ed altri no non é ancora stato chiarito, anche se sembra essere coinvolta la risposta immunitaria. Un riscontro di un elevato tasso di IgG verso le due tossine é stato associato ad un aumento di colonizzazioni asintomatiche e l’immunizzazione sperimentale sugli animali tramite la somministrazione di tali IgG mostra un effetto protettivo in tal senso.
FATTORI DI RISCHIO:
I fattori di rischio più importanti per l’infezione da C. difficile rimane l’utilizzo degli antibiotici; teoricamente tutti gli antibiotici sono associati alla comparsa di tale malattia, anche se esistono alcune classi di antibiotici che mostrano una maggiore predisposizione allo sviluppo di malattia, in particolare le penicilline, la clindamicina, il cloramfenicolo ed i fluorochinolinici. Anche altri antibiotici a largo spettro sono un fattore di rischio importante, perché tutti questi antibiotici agiscono riducendo il microbioma intestinale, favorendo pertanto la colonizzazione e la crescita degli agenti più resistenti agli antibiotici, fra cui infatti le spore del C. difficile.
La presenza di altri pazienti contaminati aumenta il rischio di infezione; durante piccole «epidemie» di colite da C. difficile il rischio di contaminazione é di circa 10 volte maggiore rispetto al solito. Anche l’età oltre i 65 anni é un fattore di rischio per la manifestazione clinica della colite da C. difficile, così come il ricovero ospedaliero é un’altro importante fattore di rischio, probabilmente come epifenomeno di numerosi fattori di rischio associati l’uno all’altro (malattia debilitante, uso di antibiotici, presenza di germi resistenti, ecc…).
L’uso degli inibitori di pompa protonica (PPI) é stato associato ad un aumentato rischio di infezione da C. difficile, per la ridotta selezione dei germi che transitano nello stomaco e raggiungono l’intestino. Gli studi sono ancora dubbi in tal senso, anche perché dal punto di vista fisiopatologico le spore batteriche sono comunque resistenti agli acidi gastrici, per cui la presenza o l’assenza di acidità gastrica non ha alcun effetto sulla selezione direttamente delle spore.
DIAGNOSI E PREVENZIONE:
L’infezione da C. difficile viene correntemente diagnosticata tramite test immunoenzimatici con la ricerca della tossina nelle feci (test principale, rapido e facilmente eseguibile) che tramite la ricerca di test del DNA per la ricerca del gene della tossina nelle feci che rileva la presenza di ceppi tossigenici e mostra un’elevata sensibilità e specificità rispetto al test immunoenzimatico. La coltura richiede un terreno in anaerobiosi e non é sempre disponibile e generalmente si richiede per pazienti che mostrano segni clinici di diarrea sospetti per infezione da C. difficile; non si deve eseguire tale ricerca in pazienti che non mostrano i segni clinici di diarrea.
Non esistendo alcun vaccino, il controllo della infezione si basa sulla riduzione d’uso di antibiotici, la prevenzione della diffusione della colonizzazione tramite opportune misure di igiene ospedaliero e l’uso di probiotici. Per quello che riguarda la riduzione degli antibiotici uno studio scozzese ha mostrato come la proibizione dell’uso di Ceftriaxone e Ciprofloxacina associato ad un’informazione adeguata ha ridotto le infezioni da C. difficile del 77% in un ospedale da 450 posti letto; purtroppo tale azione risulta estremamente costosa e difficile da mettere in pratica, soprattutto nel lungo termine. Per l’igiene ospedaliera é stato dimostrato che alcuni germi sono presenti sugli stetoscopi e sul materiale presente nelle camere (telefoni, letti, bagni, fomiti, ecc…) e bisogna ricordarsi che l’uso di soluzioni basate sull’alcol non sono in grado di eliminare le spore. È pertanto necessario usare il lavaggio delle mani con acqua e sapone dopo ogni paziente con certo/sospetta infezione da C. difficile. Inoltre, ogni paziente sospetto deve essere isolato con metodo « da contatto » per prevenire un’ulteriore diffondersi dell’infezione. L’utilizzo di probiotici sembra un metodo sicuro e facilmente adottabile per la riduzione del tasso di colonizzazione, anche se studi recenti hanno mostrato risultati contraddittori e non chiari per identificare quale sia la popolazione che realmente possa beneficiare del loro uso. Di contro, particolari effetti collaterali nel loro utilizzo non sembrano essere stati riscontrati.
TERAPIA:
L’uso del Metronidazolo e della Vancomicina orale sono i trattamenti principali contro il battere fin dagli anni ’70 e nonostante il loro ampio utilizzo, ad oggi non sono emersi ceppi particolarmente resistenti a tale terapia antibiotica. Per le coliti severe é stato dimostrato come la Vancomicina orale sia meglio del metronidazolo, ma per le forme lievi-moderate i due antibiotici sembrano essere equivalenti (alcuni studi più recenti mostrano una maggiore efficacia della Vancomicina). Nel 2011 é stata introdotta in clinica la Fidaxomicina, un antibiotico della famiglia dei macrolidi, poco assorbito, ad attività battericida che mostra una particolare azione vostro di batteri anaerobica gram-positivi ed attualmente approvato dalla FDA per il trattamento dell’infezione da C. difficile. Al momento il suo recente utilizzo in clinica ed i costi più elevati rispetto alla terapia tradizionale, lascia ancora un piccolo spazio al suo uso clinico.
Nonostante la relativa « facilità » di trattamento, iI rischio di ricorrenza si attesta attorno al 20% per un primo episodio, rischio che arriva fino al 60% nei pazienti che mostrano due o più episodi di recidiva. I costi associati ad infezioni ricorrenti possono superare i costi di una prima infezione. Generalmente la ricorrenza é generata o da una nuova esposizione al batterio oppure alla presenza di spore inattive che si attivano successivamente ad uno stato debilitativo del paziente.
Per un primo episodio di riattivazione, generalmente si inizia una terapia antibiotica (Metronidazolo o Vancomicina orale) per 10-14 giorni, con un tasso di successo nel 50% dei pazienti; le ricorrenze successive possono essere trattate ancora nella stessa maniera oppure con la Fidaxomicina (200 mg bid PO per 10 giorni) oppure con la Vancomicina somministrata in maniera scalare o a bolus; studi recenti mostrano come la Fidaxomicina sia più efficace della Vancomicina nella prevenzione delle ricorrenze in tali situazioni. Nel caso di coliti fulminanti con scarsa risposta alla terapia antibiotica e sviluppo di megacolon tossico, la mortalità si aggira attorno all’80% e l’unica terapia é la colectomia totale in emergenza per via chirurgica.
Il trasporto del microbioma intestinale umano da una persona sana ad un paziente con C. difficile é stato studiato ed alcuni primi studi mostrano che tale tecnica, associata ad una sospensione della terapia antibiotica (se possibile) si associa ad un recupero delle funzioni intestinali con riduzione del tasso di recidive. Quali siano i componenti precisi del microbioma che portano a tale azione benefica non é chiaro, ma potrebbe essere l’insieme di tutta la flora l’elemento chiave che porta ad una « competizione per il territorio » con riduzione delle possibilità di sviluppo e crescita di C. difficile. La terapia rimane ancora sperimentale e non ampiamente utilizzata.
L’uso della immunizzazione passiva contro le due tossine si é dimostrata efficace su studi animali nel prevenire la manifestazione clinica della diarrea indotta dalle tossine; qualche studio eseguito sull’uomo in tal senso ha mostrato i primi effetti. Teoricamente, pertanto, lo sviluppo di una vaccinazione contro le due tossine potrebbe essere una possibilità di prevenzione; gli studi di fase 1 hanno mostrato una buona efficacia, anche se al momento siamo a due studi internazionali placebo-controllo, che stanno testando la sicurezza e l’efficacia immunogenica nella popolazione. La speranza é quella di arrivare a sviluppare un vaccino in grado di prevenire tutte le complicanze legate all’infezione da C. difficile.
REFERENCES:
1. Hall IC, O’Toole E. Intestinal flora in newborn infants with a description of a new pathogenic anaerobe, Bacillus difficilis.Am J Dis Child 1935;49:390-3.
2. Lessa FC, Mu Y, Bamberg WM, et al. Burden of Clostridium difficile infection in the United States. N Engl J Med 2015;372: 825-34.
3. Lofgren ET, Cole SR, Weber DJ, Anderson DJ, Moehring RW. Hospital-acquired Clostridium difficile infections: estimating all-cause mortality and length of stay.Epidemiology 2014;25:570-5.
4. Zimlichman E, Henderson D, Tamir O, et al. Health care-associated infections: a meta-analysis of costs and financial impact on the US health care system.JAMA Intern Med 2013;173:2039-46.
5. Rupnik M. Is Clostridium difficile-associated infection a potentially zoonotic and foodborne disease? Clin Microbiol Infect 2007;13:457-9.
6. Jangi S, Lamont JT. Asymptomatic colonization by Clostridium difficile in infants: implications for disease in later life. J Pediatr Gastroenterol Nutr 2010;51: 2-7.
7. Viscidi R, Laughon BE, Yolken R, et al. Serum antibody response to toxins A and B of Clostridium difficile. J Infect Dis 1983; 148:93-100.
8. Rousseau C, Poilane I, De Pontual L, Maherault AC, Le Monnier A, Collignon A. Clostridium difficile carriage in healthy infants in the community: a potential reservoir for pathogenic strains. Clin Infect Dis 2012;55:1209-15.
9. Eglow R, Pothoulakis C, Itzkowitz S, et al. Diminished Clostridium difficile toxin A sensitivity in newborn rabbit ileum is associated with decreased toxin A receptor. J Clin Invest 1992;90:822-9.
10. O’Connor JR, Johnson S, Gerding DN. Clostridium difficile infection caused by the epidemic BI/NAP1/027 strain. Gastroenterology 2009;136:1913-24.
11. McDonald LC, Killgore GE, Thomp- son A, et al. An epidemic, toxin gene–variant strain of Clostridium difficile. N Engl J Med 2005;353:2433-41.
12. Akerlund T, Persson I, Unemo M, et al. Increased sporulation rate of epidemic Clostridium difficile type 027/NAP1. J Clin Microbiol 2008;46:1530-3.
13. Loo VG, Poirier L, Miller MA, et al. A predominantly clonal multi-institutional outbreak of Clostridium difficile–associated diarrhea with high morbidity and mortality. N Engl J Med 2005;353:2442-9.
14. Warny M, Pepin J, Fang A, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005;366:1079-84.
15. Kyne L, Warny M, Qamar A, Kelly CP. Asymptomatic carriage of Clostridium difficile and serum levels of IgG antibody against toxin A. N Engl J Med 2000;342: 390-7.
16. Ghose C, Kalsy A, Sheikh A, et al. Transcutaneous immunization with Clostridium difficile toxoid A induces systemic and mucosal immune responses and toxin A-neutralizing antibodies in mice. Infect Immun 2007;75:2826-32.
17. Lowy I, Molrine DC, Leav BA, et al. Treatment with monoclonal antibodies against Clostridium difficile toxins. N Engl J Med 2010;362:197-205.













0 Response to "Infezione da C. difficile (Capitolo 6.1.3)"
Posting Komentar