Terminiamo quest'ultimo capitolo dedicato interamente alle patologie valvolari cardiache parlando di cardiopatia ipertrofica ostruttiva (HOCM), entità clinica in parte geneticamente determinata e che provoca, seppure con meccanismi differenti, delle anomalie ventricolari strutturali e funzionali riconducibili a meccanismi già visti in precedenza con altre valvulopatie, in particolare con la stenosi valvolare aortica, con l'insufficienza mitralica ed in parte con l'insufficienza valvolare aortica.
DIAGNOSI:
La diagnosi viene fatta dimostrando: a) un’ipertrofia del ventricolo sinistro; b) in assenza di una causa (ipertensione arteriosa, stenosi aortica, stenosi sottovalvolari etc). Elementi che rendono ancora più probabile la diagnosi sono: a) un pattern di ipertrofia caratteristicamente asimmetrico, con interessamento prevalente del setto interventricolare ed un rapporto tra lo spessore del setto e della parete posteriore superiore a 1.4; b) un grado severo di ipertrofia, spesso associato a riduzione delle dimensioni della cavità ventricolare sinistro; c) la presenza di ostruzione all’efflusso del ventricolo sinistro associata ad insufficienza mitralica secondaria a movimento sistolico del lembo anteriore (SAM); d) una compromissione della funzione diastolica.
La diagnosi differenziale più delicata nel giovane riguarda l’ipertrofia dell’atleta; nell’atleta l’ipertrofia è simmetrica, solo raramente è severa, la cavità ventricolare sinistra e destro sono normali o lievemente dilatate, la funzione sistolica e diastolica sono normali. I soggetti con cardiomiopatia ipertrofica hanno nella maggior parte dei casi un’ipertrofia del setto di grado moderato-severo, compresa tra 15 e 25 mm, volumi cavitari ridotti, segni di disfunzione diastolica, ostruzione all’efflusso sinistro basale o da sforzo. La diagnosi differenziale più frequente ed in alcuni casi più difficile nell’adulto è con la cardiopatia ipertensiva. Più difficile perché esistono molti elementi comuni: l’ipertrofia può essere severa ed asimmetrica; in alcune condizioni si può manifestare ostruzione all’efflusso sinistro. La cardiomiopatia ipertrofica e l’ipertensione possono coesistere. L’amiloidosi si differenzia per la presenza solitamente di una malattia cronica, bassi voltaggi periferici all’ECG, la simmetricità dell’ipertrofia, l’assenza di ostruzione, la presenza di dilatazione di entrambi gli atri con inspessimento del setto interatriale ed un pattern transmitralico di tipo restrittivo. La malattia di Fabry è molto più rara, sono presenti altri segni sistemici della malattia, l’ipertrofia è simmetrica e non ostruttiva. Due segni sono indicativi: l’immagine a binario, dovuta ad una maggiore ecoriflettenza dell’endocardio e l’inspessimento e la ridondanza valvolare.
ENTITÀ E DISTRIBUZIONE DELL'IPERTROFIA:
L’entità dell’ipertrofia è: a) un elemento importante per la diagnosi differenziale; b) ha un valore prognostico; c) determina alcune scelte terapeutiche. Come abbiamo visto la maggior parte dei pazienti con cardiomiopatia ipertrofica ha un’ipertrofia di severa entità che li differenzia da un’ipertrofia da altre cause. Valori al di sopra dei 20 mm sono pressochè patognomonici. Maggiore è l’entità dell’ipertrofia maggiore il rischio di morte improvvisa. Uno spessore del setto superiore a 30 mm è una delle condizioni che indica l’impianto del defibrillatore.
La distribuzione dell’ipertrofia è variabile: nelle forme più tipiche è asimmetrica, interessa il setto, prevalentemente la porzione basale; altre sono caratterizzate da ipertrofia simmetrica o concentrata all’apice. Lo spessore del setto basale è un dato importante nei casi che debbano essere trattati invasivamente per decidere la possibilità di asportazione con la miectomia. L’intervento chirurgico non è indicato, per l’elevato rischio di perforazione del setto ventricolare, nei casi di spessore inferiore a 18 mm.
OSTRUZIONE ALL'EFFLUSSO SINISTRO:
Le cardiomiopatie ipertrofiche vengono divise in forme ostruttive e non ostruttive in base al riscontro di un gradiente nell’efflusso ventricolare sinistro. Il valore cut off è di 30 mm Hg di gradiente massimo. Il gradiente è presente in circa il 10% dei pazienti in condizioni basali ma la percentuale sale fino al 70% durante lo sforzo. I meccanismi che portano all’ostruzione sono diversi e complessi ma possono essere esemplificati in 2 categorie: una dinamica ed una anatomica, più rara. Il particolare tipo di rimodellamento ventricolare indotto dall’ipertrofia del setto, dalla riduzione dei volumi e dal successivo sposizionamento dei papillari comporta modificazioni dei vettori dei flussi intraventricolari che portano a spingere ed a risucchiare il lembo anteriore della mitrale verso l’efflusso sinistro (SAM) provocando contemporaneamente l’ostruzione dinamica all’efflusso sinistro e l’insufficienza mitralica. Più raramente il papillare anteriore è anteroposto o si connette direttamente al lembo anteriore senza interposizione di corde provocando un’ostruzione di tipo anatomico.
La presenza di ostruzione comporta: a) un trattamento medico di prima scelta differente: viene privilegiato il betabloccante invece del verapamil che viene invece impiegato nelle forme non ostruttive; b) una maggior evolutività verso lo scompenso (intorno al 30% a 7 anni); c) una maggiore mortalità globale, in particolare al di sopra dei 40 anni; d) la possibilità di una terapia meccanica di tipo chirurgico o interventistico nei casi di fallimento del trattamento medico. Dell’ostruzione viene definita l’entità, la sede ed il meccanismo.
- L’entità dell’ostruzione dinamica è variabile con le condizioni di carico e le variazioni di contrattilità cardiaca. L’ipovolemia e l’aumento della contrattilità, come avviene durante uno sforzo o per la somministrazione di farmaci inotropi positivi, evocano o peggiorano l’ostruzione, l’aumento del postcarico, ad esempio per un aumento della pressione arteriosa, la riduce. Il gradiente può quindi variare spontaneamente da una rilevazione ad un’altra. Un gradiente massimo superiore a 50 mm Hg in un paziente sintomatico in terapia medica è un’indicazione al trattamento meccanico che consiste nell’alcoolizzazione transcatetere del setto (PTSMA) o nella miectomia chirurgica (v. analisi decisionale ecoguidata).
- La sede dell’ostruzione è abitualmente localizzata a livello del tratto di efflusso o più raramente medioventricolare. L’ostruzione nel tratto di efflusso è dovuta all’ipertrofia asimmetrica del setto. L’ostruzione in sede medioventricolare è causata di solito da anomalie anatomiche da malposizione dei papillari che non possono essere trattate per via transcatetere e richiedono il trattamento chirurgico. Più raramente l’ostruzione può estendersi al tratto di efflusso destro.
- Il meccanismo nella maggior parte dei casi come abbiamo visto è di tipo funzionale dovuto allo spostamento del lembo anteriore (spinto dalle drag forces e risucchiato dall’effetto Venturi) verso il tratto di efflusso in sistole. Più raramente, quando l’ostruzione è medioventricolare, è di tipo anatomico dovuta al contatto prolungato tra il setto ipertrofico ed un muscolo papillare anteroposto.
La sede ed il meccanismo dell’ostruzione sono molto importanti per definire l’approccio terapeutico sia farmacologico che interventista.
INSUFFICIENZA MITRALICA
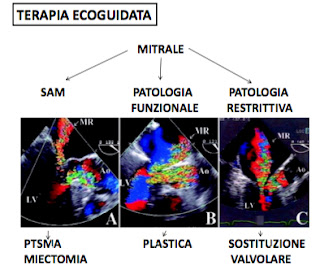
La valvola mitralica è spesso coinvolta nei pazienti con cardiomiopatia ipertrofica. Il coinvolgimento nella maggior parte dei casi è di tipo funzionale ma a volte è dovuto ad anomalie intrinseche della valvola. E’ importante riconoscere questo sottogruppo in cui la terapia medica è scarsamente efficace, l’alcoolizzazione transcatetere non ha alcun senso e si deve quindi ricorrere alla chirurgia. In sintesi l’insufficienza mitralica è dovuta a 3 cause (in ordine di frequenza): a) il SAM in cui l’insufficienza è dovuta alla mancata coaptazione secondaria allo spostamento del lembo anteriore verso l’efflusso sinistro; b) il prolasso dei lembi, riconducibile all’alterata tensione delle corde causata dall’anomalia di posizione dei papillari e dalla riduzione della cavità; c) la patologia intrinseca della valvola di tipo restrittivo dovuta o alle alterazioni fibro-calcifiche secondarie al trauma del ripetuto contatto con il setto oppure più raramente per l’anomalia anatomica rappresentata dalla connessione diretta del papillare con il lembo anteriore senza interposizione cordale.
L’identificazione delle anomalie intrinseche della mitrale è importante dal punto di vista della strategia terapeutica; il movimento sistolico anteriore è solitamente reversibile dopo essere intervenuti sul setto (PTSMA o miectomia). Le anomalie intrinseche richiedono un intervento diretto sulla mitrale, a sua volta differente sulla base dell’alterazione morfologica: plastica mitralica nei casi di prolasso, sostituzione valvolare nei casi di patologia restrittiva e connessione anomala del papillare.
FUNZIONE SISTOLICA - DIASTOLICA VENTRICOLARE:
La funzione diastolica è spesso compromessa dall’ipertrofia ma non vi sono strette correlazioni tra i parametri doppler, l’entità dell’ipertrofia e gli indici invasivi di disfunzione diastolica. Finora non è stata dimostrata una correlazione tra i parametri doppler e la mortalità a distanza. La funzione sistolica globale è compromessa solitamente nella fase avanzata della malattia, in età adulta, ed in una percentuale di pazienti intorno al 10%. L’evoluzione verso la disfunzione sistolica è preceduta da un assottigliamento degli spessori ed una progressiva dilatazione dei volumi. Una volta che si manifesta comporta un incremento di mortalità fino al 10% / anno ed una rapida evoluzione verso lo scompenso e la morte improvvisa. Un numero maggiore di pazienti presenta alterazioni della funzione sistolica longitudinale che sono visibili solo al doppler tissutale. Le alterazioni doppler della funzione diastolica e sistolica vengono utilizzate per la diagnosi differenziale con il cuore di atleta e nello screening dei famigliari. Il volume dell’atrio sinistro rispecchia il burden diastolico della malattia e la gravità dell’insufficienza mitralica. Le dimensioni dell’atrio sinistro correlano con il rischio di insorgenza della fibrillazione atriale e di stroke. La fibrillazione atriale a sua volta è un predittore di mortalità, in particolare nei pazienti con ostruzione.
ANALISI DECISIONALE ECOGUIDATA
La maggior parte dei pazienti sintomatici con cardiomiopatia ipertrofica viene trattata con la sola terapia medica. In assenza di ostruzione il trattamento di prima scelta è con il verapamil. Nei casi di ostruzione dinamica si inizia con il betabloccante. Solo una minoranza dei pazienti con la forma ostruttiva persiste sintomatica nonostante una terapia medica piena, con un gradiente superiore ai 50 mmHg. In questi casi vi è indicazione alla terapia meccanica. La scelta del tipo di trattamento meccanico dipende dalle caratteristiche morfofunzionali della malattia rilevate dall’ecografia. I pazienti con ostruzione di tipo funzionale ed ipertrofia circoscritta al setto basale possono essere trattati sia chirurgicamente che per via percutanea.
Il trattamento chirurgico consiste nella miectomia del setto ipertrofico (intervento di Morrow). Il trattamento percutaneo viene eseguito in sala di emodinamica, e consiste, previo controllo con ecocontrasto del territorio di distribuzione del primo settale, nel provocare artificialmente un infarto pilotato, circoscritto al setto basale iniettando alcool nel primo settale (PTSMA). Quale tecnica sia preferibile è ancora un argomento dibattuto. La presenza di alcune peculiarità fa pendere la bilancia in un senso o nell’altro. Una distribuzione anomala del primo settale che interessi larga parte del setto, il ventricolo destro o un papillare è chiaramente una controindicazione all’alcoolizzazione, per il rischio di indurre un infarto troppo esteso, ed è quindi un’indicazione obbligatoria alla miectomia. Uno spessore del setto inferiore ai 18 mm non è una buona indicazione alla miectomia per il rischio di creazione di un difetto settale jatrogeno ed è quindi indicazione all’alcoolizzazione percutanea. I pazienti più rari che all’ecografia presentano un’anatomia dell’ostruzione di tipo strutturale e complessa: setto severamente ed estesamente ipertrofico, patologia intrinseca della mitrale, connessione diretta dei papillari vanno incontro alla chirurgia. La miectomia estesa, la riparazione della mitrale in caso di prolasso o la sostituzione in caso di connessione diretta del papillare.
Il trattamento chirurgico consiste nella miectomia del setto ipertrofico (intervento di Morrow). Il trattamento percutaneo viene eseguito in sala di emodinamica, e consiste, previo controllo con ecocontrasto del territorio di distribuzione del primo settale, nel provocare artificialmente un infarto pilotato, circoscritto al setto basale iniettando alcool nel primo settale (PTSMA). Quale tecnica sia preferibile è ancora un argomento dibattuto. La presenza di alcune peculiarità fa pendere la bilancia in un senso o nell’altro. Una distribuzione anomala del primo settale che interessi larga parte del setto, il ventricolo destro o un papillare è chiaramente una controindicazione all’alcoolizzazione, per il rischio di indurre un infarto troppo esteso, ed è quindi un’indicazione obbligatoria alla miectomia. Uno spessore del setto inferiore ai 18 mm non è una buona indicazione alla miectomia per il rischio di creazione di un difetto settale jatrogeno ed è quindi indicazione all’alcoolizzazione percutanea. I pazienti più rari che all’ecografia presentano un’anatomia dell’ostruzione di tipo strutturale e complessa: setto severamente ed estesamente ipertrofico, patologia intrinseca della mitrale, connessione diretta dei papillari vanno incontro alla chirurgia. La miectomia estesa, la riparazione della mitrale in caso di prolasso o la sostituzione in caso di connessione diretta del papillare.
PARASTERNALE ASSE LUNGO
La parasternale asse lungo è spesso la proiezione diagnostica. Già alla valutazione inspettiva con il B-mode si visualizza un’ipertrofia solitamente di severa entità, tipicamente asimmetrica a favore del setto interventricolare basale ed in alcuni casi il movimento del lembo anteriore della mitrale verso l’efflusso sinistro che porta all’ostruzione sistolica. Con l’M-mode si misurano gli spessori ed i diametri. Un rapporto tra lo spessore del setto e la parete posteriore superiore a 1.4 è diagnostico. Uno spessore del setto inferiore a 18 mm costituisce una controindicazione ad un’eventuale miectomia.
L’ipertrofia del setto comporta di solito una riduzione del diametro telediastolico inferiore a 45 mm. Sempre con l’M-mode si misura il diametro atriale sinistro, espressione del burden emodinamico. Poi si ripassa nuovamente al B-mode accentrando l’attenzione sul tratto di efflusso e sulla valvola aortica. Nel tratto di efflusso si studia la presenza o l’assenza di SAM. In caso di assenza di SAM si deve escludere una stenosi aortica, confermando una normale apertura delle cuspidi; molta attenzione va posta per escludere la rara presenza di una membrana sottovalvolare aortica che richiederebbe un trattamento chirurgico di asportazione. La membrana può essere subito al di sotto del piano valvolare e può sfuggire ad una visione superficiale. Nei casi in cui persista un dubbio è indicato l’esame TE. Nei casi con SAM la diagnosi di forma ostruttiva è fatta; non resta che accendere il doppler a colori che caratteristicamente dimostra una doppia turbolenza: nell’efflusso sinistro a causa del SAM ed in atrio sinistro, per l’insufficienza mitralica. In altri casi non è presente il SAM ma si visualizza il muscolo papillare anteriore ulteriormente anteriorizzato che in sistole viene a contatto con il setto ventricolare ipertrofico provocando l’ostruzione.
Terminata l’analisi del tratto di efflusso si passa alla valutazione della anatomia della mitrale. Nella maggior parte dei casi la valvola è morfologicamente normale. Viene subito esclusa la rara connessione diretta tra il papillare anteriore ed il lembo. Infine viene ricercata la presenza di un eventuale prolasso. In ultimo si accende il doppler e si visualizza la presenza di un eventuale rigurgito e la direzione del jet. Tipicamente nel SAM la direzione del jet è verso la parete posteriore dell’atrio. Una direzione differente, unita ai dati morfologici, deve far sospettare una patologia intrinseca della valvola.
ASSE CORTO
Con l’ecografia B-mode in asse corto si visualizza bene l’asimmetricità e la sede dell’ipertrofia. Spostandosi verso l’efflusso ventricolare destro si ricerca la rara presenza di ostruzione.
APICALE 4-5 CAMERE
Nell’apicale 4-5 camere si rivaluta la morfologia del ventricolo sinistro e si quantifica l’entità, la sede ed il meccanismo dell’eventuale ostruzione all’efflusso sinistro per poi passare alla valutazione dell’insufficienza mitralica, della funzione ventricolare e del volume atriale sinistro.
Con l’ecografia B-mode si conferma l’ipertrofia eccentrica del setto basale o medio, la presenza del SAM e spesso la dilatazione dell’atrio sinistro. I volumi ventricolari sinistri sono normali o ridotti dall’ipertrofia, l’EF è abitualmente conservata. Nelle fasi avanzate della malattia in circa il 10% dei pazienti la funzione sistolica si deteriora ed i volumi aumentano. In telesistole si misura il volume atriale sinistro che spesso supera i 50 ml. A questo punto si accende prima il doppler pulsato in mezzo ai lembi mitralici, poi il doppler tissutale sull’anulus laterale e si valutano la funzione diastolica e la sistolica longitudinale. La funzione diastolica è spesso alterata con pattern da alterato rilasciamento ed intermedi. La funzione sistolica longitudinale è frequentemente compromessa e questo è un segno caratteristico che differenzia la cardiomiopatia ipertrofica dall’ipertrofia dell’atleta.
Terminato lo studio del ventricolo sinistro si passa alla valutazione dell’anatomia dell’efflusso sinistro ed all’entità del gradiente con il doppler continuo. Il gradiente si misura allineandosi con il color sull’efflusso sinistro. Tipicamente la morfologia doppler è a sciabola (dagger-shaped) con picco telesistolico. Queste caratteristiche la differenziano dal rigurgito mitralico che può essere erroneamente campionato nella stessa proiezione che è più precoce, arrontodato e di velocità maggiore.
Un gradiente massimo superiore a 30 mm Hg è considerato diagnostico della forma ostruttiva. Per localizzare la sede dell’ostruzione – medioventricolare o all’efflusso sinistro – si usa il color ed il doppler pulsato, uniti alle informazioni anatomiche del B-mode. Dove inizia la turbolenza al color e la comparsa del gradiente al pulsato lì è l’ostruzione. A questo punto si rivolge l’attenzione allo studio della mitrale. Dapprima con il B-mode per studiarne la morfologia ed il movimento dei lembi: il SAM, la presenza di prolasso, le alterazioni fibrocalcifiche che riducono l’apertura dei lembi. In questa proiezione non si vede bene la connessione diretta. Poi si passa al color per visualizzare la sede e l’entità del rigurgito. Nel SAM il rigurgito è spesso correlato all’entità del gradiente ed alla durata del contatto setto-lembo anteriore. La direzione del jet è verso la parete postero-laterale dell’atrio. Al contrario nel prolasso, che solitamente interessa il lembo posteriore, il rigurgito è verso la parete settale. Un rigurgito centrale è tipico della patologia restrittiva o di un prolasso di entrambi i lembi. L’esame viene completato con lo studio del ventricolo destro. Il riscontro di un elevato gradiente atrio-ventricolare destro deve far sospettare la presenza di un’ostruzione all’efflusso ventricolare destro che viene diagnosticata con l’ecografia TE. Una riduzione della componente sistolica del TDI è un altro segno che differenzia la cardiomiopatia ipertrofica dal cuore di atleta.
ECO STRESS
La maggior parte dei pazienti con cardiopatia ipertrofica non ha ostruzione a riposo ma la sviluppa durante lo sforzo causando la dispnea. In tutti i soggetti sintomatici è quindi indicata una valutazione con un eco da sforzo per quantificare il gradiente e valutarne l’importanza emodinamica (ipotensione). La presenza di gradiente da sforzo e dispnea sono indicazione alla terapia betabloccante. Un gradiente da sforzo superiore a 50 mm Hg in un pazienti sintomatico è oggi indicazione alla terapia interventista.
RIPETIZIONE ECO in TERAPIA
L’ecografia viene ripetuta dopo che è stata iniziata la terapia medica per valutarne l’efficacia in termini di riduzione del gradiente. Purtroppo la variabilità spontanea del gradiente e la mancanza di dati sicuri che dimostrino una correlazione tra regressione del gradiente e miglioramento dell’outcome rendono incerta l’interpretazione del risultato.
REFERENCES:
1. Sakamoto T. Apical hypertrophic cardiomyopathy (apical hypertrophy): an overview. J. Cardiol. 2001;37(Suppl. 1):161–178.
2. Moon J.C.C., G. FN, McKenna W.J., Pennell D.J. Detection of apical hypertrophic cardiomyopathy by cardiovascular magnetic resonance in patients with non-diagnostic echocardiography. Heart. 2004;90:645–649.
3. Maron M.S., Maron B.J., Harrigan C., Buros J., Gibson C.M., Olivotto I., Biller L., Lesser J.R., Udelson J.E., Manning W.J. Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J. Am. Coll. Cardiol. 2009;54:220–228.
4. Moon J.C., McKenna W.J. The emerging role of cardiovascular magnetic resonance in refining the diagnosis of hypertrophic cardiomyopathy. Nat. Clin. Pract. Cardiovasc. Med. 2009;6:166–167.
5. Rickers C., Wilke N.M., Jerosch-Herold M., Casey S.A., Panse P., Panse N., Weil J., Zenovich A.G., Maron B.J. Utility of cardiac magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. Circulation. 2005;112:855–861.
6. Elliott P., Andersson B., Arbustini E., Bilinska Z., Cecchi F., Charron P., Dubourg O., Kuhl U., Maisch B., McKenna W.J., Monserrat L., Pankuweit S., Rapezzi C., Seferovic P., Tavazzi L., Keren A. Classification of the cardiomyopathies: a position statement from the European society of cardiology working group on myocardial and pericardial diseases. Eur. Heart J. 2008;29:270–276.
7. Maron B.J., Towbin J.A., Thiene G., Antzelevitch C., Corrado D., Arnett D., Moss A.J., Seidman C.E., Young J.B. Contemporary definitions and classification of the cardiomyopathies: an american heart association scientific statement from the council on clinical cardiology, heart failure and transplantation committee; quality of care and outcomes research and functional genomics and translational biology interdisciplinary working groups; and council on epidemiology and prevention. Circulation. 2006;113:1807–1816.
8. Gersh B.J., Maron B.J., Bonow R.O., Dearani J.A., Fifer M.A., Link M.S., Naidu S.S., Nishimura R.A., Ommen S.R., Rakowski H., Seidman C.E., Towbin J.A., Udelson J.E., Yancy C.W. 2011 accf/aha guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American college of cardiology foundation/American heart association task force on practice guidelines. J. Am. Coll. Cardiol. 2011;58:2703–2738.
9. Kramer C.M., Barkhausen J., Flamm S.D., Kim R.J., Nagel E. Standardized cardiovascular magnetic resonance imaging (cmr) protocols, society for cardiovascular magnetic resonance: board of trustees task force on standardized protocols. J. Cardiovasc. Magn. Reson. 2008;10:35.
10. Kim R.J., Shah D.J., Judd R.M. How we perform delayed enhancement imaging. J. Cardiovasc. Magn. Reson. 2003;5:505–514.
11. Flett A.S., Hasleton J., Cook C., Hausenloy D., Quarta G., Ariti C., Muthurangu V., Moon J.C. Evaluation of techniques for the quantification of myocardial scar of differing etiology using cardiac magnetic resonance. J. Am. Coll. Cardiol. Cardiovasc. Imaging. 2011;4:150–156.
12. Hudsmith L., Petersen S., Francis J., Robson M., Neubauer S. Normal human left and right ventricular and left atrial dimensions using steady state free precession magnetic resonance imaging. J. Cardiovasc. Magn. Reson. 2005;7:775–782.
13. Pelliccia A., Di Paolo F.M., Quattrini F.M., Basso C., Culasso F., Popoli G., De Luca R., Spataro A., Biffi A., Thiene G., Maron B.J. Outcomes in athletes with marked ecg repolarization abnormalities. N. Engl. J. Med. 2008;358:152–161.
14. Rudolph A., Abdelaty H., Bohl S., Boye P., Zagrosek A., Dietz R., Schulzmenger J. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy relation to remodeling. J. Am. Coll. Cardiol. 2009;53:284–291
15. Sakamoto T., Tei C., Murayama M., Ichiyasu H., Hada Y. Giant T wave inversion as a manifestation of asymmetrical apical hypertrophy (aah) of the left ventricle. Echocardiographic and ultrasono-cardiotomographic study. Jpn. Heart J. 1976;17:611–629.
16. Alfonso F., Nihoyannopoulos P., Stewart J., Dickie S., Lemery R., McKenna W.J. Clinical significance of giant negative T waves in hypertrophic cardiomyopathy. J. Am. Coll. Cardiol. 1990;15:965–971
17. Yamaguchi H., Ishimura T., Nishiyama S., Nagasaki F., Nakanishi S., Takatsu F., Nishijo T., Umeda T., Machii K. Hypertrophic nonobstructive cardiomyopathy with giant negative T waves (apical hypertrophy): ventriculographic and echocardiographic features in 30 patients. Am. J. Cardiol. 1979;44:401–412.
18. Suzuki J., Watanabe F., Takenaka K., Amano K., Amano W., Igarashi T., Aoki T., Serizawa T., Sakamoto T., Sugimoto T., Nishikawa J. New subtype of apical hypertrophic cardiomyopathy identified with nuclear magnetic resonance imaging as an underlying cause of markedly inverted T waves. J. Am. Coll. Cardiol. 1993;22:1175–1181.
19. Fattori R., Biagini E., Lorenzini M., Buttazzi K., Lovato L., Rapezzi C. Significance of magnetic resonance imaging in apical hypertrophic cardiomyopathy. Am. J. Cardiol. 2010;105:1592–1596.
20. Ates M., Kwong R.Y., Lipton M.J., Tatli S. Apical hypertrophic cardiomyopathy: diagnosed by cardiac magnetic resonance imaging. Tex. Heart Inst. J. 2006;33:408–409
21. Maron M.S., Finley J.J., Bos J.M., Hauser T.H., Manning W.J., Haas T.S., Lesser J.R., Udelson J.E., Ackerman M.J., Maron B.J. Prevalence, clinical significance, and natural history of left ventricular apical aneurysms in hypertrophic cardiomyopathy. Circulation. 2008;118:1541–1549
22. Mogensen J., Murphy R.T., Kubo T., Bahl A., Moon J.C., Klausen I.C., Elliott P.M., McKenna W.J. Frequency and clinical expression of cardiac troponin i mutations in 748 consecutive families with hypertrophic cardiomyopathy. J. Am. Coll. Cardiol. 2004;44:2315–2325.










0 Response to "Cardiopatia ipertrofica ostruttiva (Capitolo 2.12.7)"
Posting Komentar