Le bradiaritmie ed i blocchi di conduzione sono fenomeni frequenti in terapia intensiva; diverse manifestazioni cliniche e reperti patologici si verificano in questo ambito; alcune bradiaritmie sono benigne ed asintomatiche, non necessitando pertanto di qualche trattamento. Altre aritmie, in particolare i blocchi atrioventricolari (AV) sono fenomeni potenzialmente mortali che richiedono spesso un intervento immediato. Dopo che abbiamo trattato nel capitolo precedente della normale conduzione cardiaca (si veda il capitolo dedicato all’introduzione sulle aritmie, Capitolo 2.5.1), in questo capitolo parleremo in maniera più specifica delle bradiaritmie e delle possibilità terapeutiche in ICU.
Il fallimento di conduzione degli impulsi può avvenire ovunque lungo il percorso di conduzione; il blocco del nodo AV è più frequentemente provocato da farmaci, da un aumento del tono parasimpatico, oppure da ischemia miocardica. I blocchi del nodo AV sono generalmente reversibili, tranne quando un infarto porta a danni permanenti di una porzione del percorso di conduzione. I blocchi infranodali raramente sono provocati da anomalie fisiologiche, mentre più frequentemente una cardiopatia strutturale o la rottura anatomica del sistema di conduzione sono le principali cause di blocco cardiaco infranodale. Alcune cause rare del blocco infranodale includono l’interruzione del fascio di His da calcificazione della valvola aortica, la malattia di Lenègre (caratterizzata da una degenerazione idiopatica delle fibre di Purkinje) e la malattia di Chagas. Una volta che il blocco è identificato, si può determinare il sito patologico della conduzione. Il sito anatomico può essere identificato in molti casi guardando alla larghezza del complesso QRS ed alla morfologia del QRS: quando il complesso QRS è stretto (inferiore a 120 msec), il sito di patologia è più probabile in sede sopraventricolare (dato cha la conduzione intraventricolare rimane inalterata); quando il complesso QRS è largo, il luogo più probabile di blocco AV è infranodale. I blocchi di branca ed i blocchi fascicolari producono varie morfologie del QRS (vedi oltre nel testo) che possono essere d’aiuto nel determinare la posizione anatomica specifica della patologia.
DIAGNOSI
A livello di manifestazioni cliniche (secondo la sindrome di Morgagni-Adams-Stokes) la clinica dipende dalla durata di ipoperfusione che si manifesta a livello cerebrale; la sincope e la presincope sono i sintomi più drammatici del disturbi di conduzione; altri sintomi possono essere palpitazioni, dispnea, angina e fatica diffusa ed improvvisa. Va ricordato però che molti pazienti sono asintomatici. Un numero significativo di pazienti inoltre sviluppa bradiaritmie dopo un infarto miocardico acuto. Un ECG di alta qualità a 12 piste è fondamentale per la valutazione appropriata delle onde P e dei vari intervalli; il monitoraggio di routine in terapia intensiva è compiuta solitamente con un elettorato singolo o tre elettrodi al letto del paziente. In casi complessi, per delineare chiaramente le onde P ed i complessi QRS può essere necessario l’uso dell’ECG esofageo.
ANOMALIE DEL NODO SA
BRADICARDIA SINUSALE
LA Bradicardia sinusale è definitA come un ritmo sinusale con una frequenza cardiaca inferiore a 60 battiti al minuto (bpm); generalmente si divide in due categorie: forme appropriate ed inappropriate. La bradicardia appropriata è identificata nei giovani, in individui sani e in atleti di resistenza; in questi casi la frequenza cardiaca aumenta in modo appropriato con l'esercizio. La bradicardia sinusale patologica non aumenta in modo appropriato con l'esercizio fisico; i farmaci sono la causa più comune della forma patologica; influenze autonome, alterazioni elettrolitiche e disturbi strutturali intra-cardiaci sono altri fattori. Nei soggetti più anziani, la bradicardia sinusale può derivare da una diminuzione della frequenza del nodo del seno, parte normale del processo di invecchiamento. L'ischemia miocardica può anche aumentare il tono vagale, risultando in una frequenza cardiaca più lenta.
ARRESTO SINUSALE
L’arresto sinusale si verifica quando le cellule pacemaker nel nodo SA non riescono a depolarizzarsi; pause inferiori ai 3 secondi possono essere viste in un massimo di 11% di individui normali e non devono destare preoccupazione. Vi è una maggiore incidenza di pausa sinusale negli atleti. Pause più lunghe di 3 secondi sono di solito considerati patologiche e dovrebbero essere valutate da uno specialista in cardiologia. Il blocco di trasmissione all’uscita del nodo SA e l’arresto sinusale appaiono simili sull’ECG, ma dovrebbero essere distinti, se possibile: la durata della pausa nel blocco di uscita è un multiplo dell'intervallo P-P. Il trattamento rimane comunque lo stesso per entrambe le condizioni.
I test non invasivi comprendono l’ECG, il massaggio del seno carotideo ed un tilt test; il massaggio del seno carotideo è utile per diagnosticare l'ipersensibilità del seno carotideo, pur bilanciando i rischi connessi al massaggio del seno carotideo (come un attacco ischemico transitorio ed ictus). Il tilt test è utile per determinare se gli episodi sincopali sono dovuti a disfunzione autonomica. Fra i test diagnostici invasiva si può fare un ECG intracavitario al nodo SA, anche se generalmente non è necessario. Il trattamento della disfunzione del nodo del seno può essere temporanea o permanente. La somministrazione di atropina o isoproterenolo in pompa-siringa possono essere utilizzati in terapia intensiva come un ponte per il posizionamento pacemaker permanente. La stimolazione temporanea è indicato per i pazienti che non rispondono alla terapia medica (secondo algoritmo ACLS).
IPERSENSIBILITÀ DEL SENO CAROTIDEO
Tale condizione patologica viene diagnosticata quando si assiste ad una asistolia ventricolare della durata maggiore di 3 secondi (di solito a causa di una pausa sinusale o di un arresto) oppure per un calo della pressione sistolica superiore a 50 mmHg in risposta al massaggio carotideo. In caso di sintomi, anche una caduta di pressione sistolica di 30 mmHg definisce una risposta positiva. Il trattamento è la posa di un pacemaker solamente nei pazienti sintomatici.
BRADIARITMIE POST-CHIRURGICHE
Le bradiaritmie sono comuni dopo la chirurgia cardiaca; la chirurgia della valvola aortica e la miectomia del setto possono causare danni significativi al sistema di conduzione. Anche l’ischemia prolungata durante il trapianto cardiaco può anche provocare danni al nodo del seno o al sistema di conduzione. La decisione di porre un pacemaker permanente non deve essere fatta fino al 5-7 giorno post-operatorio, dato che alcune bradiaritmie possono essere temporanee. Inoltre i farmaci somministrati durante l'intervento chirurgico o delle ischemie reversibili sono spesso implicate in questi disturbi. La stimolazione è generalmente necessaria dal 3,2% al 8,5% dei pazienti con chirurgia valvolare ed in circa il 10% dei pazienti con trapianto cardiaco.
ANOMALIE DEL NODO AV
Ci sono molte cause e le diverse manifestazioni di disfunzione del nodo AV, che vanno sempre ricercate ogni volta che si manifesta una aritmia di questo tipo; in primis si deve pensare ad un'ischemia cardiaca o ad un infarto del miocardico, seguito da disturbi elettrolitici (primari o infatti da malattie/farmaci), ad infezioni locali, a fenomeni di fibrosi degenerativa oppure a farmaci.
BLOCCO AV DI PRIMO GRADO
Il blocco AV di primo grado è caratterizzato da un prolungato intervallo PR (maggiore di 200 msec negli adulti e 180 msec nei bambini che non assumono farmaci). Tutte le onde P sono condotte ai ventricoli, e l'intervallo PR generalmente è fisso. Potenziali cause del blocco AV di primo grado includono un ritardo di conduzione attraverso gli atri dal nodo SA per il nodo AV, un ritardo nel nodo di conduzione AV oppure un prolungamento di conduzione infranodale.
I ritardi nella conduzione dal nodo SA per il nodo AV sono in genere dovuti a cause strutturali come l'allargamento atriale destro o un difetto del setto interatriale ostium primum; un ritardo nel nodo AV è la causa più comune di blocco AV di primo grado. I pazienti con ritardata conduzione nel nodo AV hanno spesso un intervallo PR superiore a 300 msec. Cause infranodali del blocco AV di primo grado sono rare e sono tipicamente associate ad un complesso QRS largo a causa di una malattia presente anche nel fascio di His. Il blocco AV di primo grado è in genere benigno ed asintomatico; si può notare nello 0,5% dei giovani adulti senza malattia cardiaca. Nelle persone anziane, il blocco di primo grado è più spesso il risultato di una malattia degenerativa idiopatica. Un intervallo PR prolungato è spesso un riscontro occasionale quando un ECG viene ordinato per altri motivi.
BLOCCO AV DI SECONDO GRADO MOBITZ I:
Il blocco AV di secondo grado Mobitz I, o ritmo di Wenckebach, è definito da un prolungamento progressivo dell'intervallo PR ad ogni battito successivo, con eventuale fallimento di conduzione di un'onda P ai ventricoli. Ciò si traduce nell’assenza di un battito e nel fallimento della depolarizzazione ventricolare. Le onde P si verificano a intervalli regolari. Come l'intervallo PR si allunga, l'intervallo RR diventa più breve, che alla fine si traduce in conduzione decrementale. Vi è un rapporto reciproco tra l'intervallo RP e l'intervallo PR.
La fisiopatologia del blocco AV di secondo grado tipo I è simile a quella del blocco AV di primo grado, tranne che non si ha mai una causa intra-atriale; per questioni pratiche, questo tipo di blocco si considera come un problema nella conduzione del nodo AV. Il complesso QRS è generalmente stretto ed i complessi QRS sono tipicamente raggruppati in due, tre, quattro fra loro. Il ritmo è descritto registrando il numero di onde P e di complessi QRS coinvolti nel modello di blocco (ad esempio, 4:3 oppure 3:2). Durante un battito caduto, un'onda P si osserva senza complessi QRS corrispondenti. Generalmente questo blocco è un ritmo stabile e ha una prognosi buona, molto meglio di quanto non faccia un ritmo Mobitz tipo II. Se il ritmo di Wenckebach è dovuta ad un farmaco, la risoluzione del blocco può essere controllato tramite ECG alla riduzione/sospensione del farmaco stesso.
BLOCCO AV DI SECONDO GRADO MOBITZ II:
Il blocco AV di secondo grado tipo Moritz II è caratterizzato da una improvvisa onda P non-condotta, senza un cambiamento dell'intervallo PR; all’ECG si osserva un'onda P senza complesso QRS corrispondente. Questo è un ritmo intrinsecamente instabile, spesso indice di gravi patologie. In contrasto con il tipo Mobitz I, il tipo II è descritto come un blocco ad alto grado, con rapporti P:QRS di 3:1 e 4:1; generalmente è quasi sempre a causa di un disturbo della conduzione infra-nodale. I complessi QRS sono spesso alterati in larghezza, e un blocco di branca è spesso associato. Il blocco AV di secondo grado può derivare da infarto della parete anteriore; il rischio maggiore é l’evoluzione verso un blocco cardiaco completo.
BLOCCO ATRIO-VENTRICOLARE 2:1
Quando la conduzione di ogni onda P è bloccata in maniera intermittente, si parla di blocco AV 2:1; l’intervallo PR del battito condotto rimane fisso, i complessi QRS sono regolari e si verificano a metà della frequenza atriale. Non é possibile stabilire la tipologia di Moritz, dato che non si può osservare una variazione nell’intervallo PR; ma data la severità clinica e la sintomatici del blocco, viene sempre considerato come un blocco avanzato.
BLOCCO AV DI TERZO GRADO
Il blocco AV di terzo grado è caratterizzato da una completa dissociazione atrio-ventricolare; non c'è alcuna conduzione del segnale atriale attraverso il ventricolo, quindi i sistemi atriali e ventricolari operano in modo indipendente. Sull’ECG, le onde P sono regolari fra loro e non sono associate in nessun modo con la contrazione del ventricolo. Gli intervalli di PR sono pertanto irregolari. I complessi ventricolari possono essere giunzionali (con QRS stretto, a frequenza di 40-60 bpm) oppure ventricolari (QRS allargato, frequenza inferiore a 40 bpm). A seconda della frequenza cardiaca di fuga, i pazienti possono presentare tachipnea, dispnea da sforzo, fatica, cianosi o sincope.
Per quello che riguarda le cause e la fisiopatologia, il blocco di terzo grado può essere diviso in cause congenite o acquisite. Il 60% dei pazienti con blocco cardiaco congenito è di sesso femminile. I pazienti con blocco di terzo grado congenito spesso hanno un ritmo di fuga con un tasso adeguato. Il blocco di terzo grado acquisito si verifica più frequentemente nella settima decade di vita e di solito richiede l’uso di un pacemaker permanente; questi pazienti sono spesso di sesso maschile. Altre cause specifiche comprendono l’uso di farmaci, l'ischemia miocardica, la progressione di tipo Mobitz II e l’infarto miocardico, quest’ultimo che generalmente si traduce in un blocco cardiaco di terzo grado nel 14% dei pazienti con infarto della parete inferiore e nel 2% dei pazienti con infarti anteriori. Tale blocco si osserva di solito entro 24 ore dopo un infarto miocardico; generalmente richiede un pacemaker permanente. Il trattamento in urgenza prevede la correzione di disturbi sottostanti, l’uso di un pacemaker transcutanea/IV immediato o la somministrazione di Isoprenalina in attesa del racing permanente.
TERAPIA FARMACOLOGICA
La terapia medica per i blocco AV è costituito dall’uso di atropina, agenti adrenergici, Isoprenalina e l’uso del pacemaker. L'atropina diminuisce il tono vagale ed è utile in caso di ipervagotonia ma non per i blocco AV su ischemia. L’atropina non é utile in caso di blocco AV di terzo grado o di un blocco Mobitz tipo II se la patologia è sotto al nodo AV ed è inoltre inefficace nei pazienti trapiantati di cuore. L'atropina deve essere usato con cautela nei pazienti con il tipo di Mobitz ritmi II, perché può verificarsi una diminuzione paradossale della frequenza cardiaca. Un altro farmaco eventualmente da utilizzare é l’uso dei Digibind (anticorpi anti-digossina) nei pazienti sintomatici con blocco AV indotto da digossina. Il numero di fiale di Digibind richiesti è approssimativamente uguale al peso del paziente (in kg) moltiplicato per il livello digossina sierica (in ng/mL) diviso per 100.
PACEMAKER (CENNI)
Anche se i pacemaker sono generalmente affidabili, i pazienti a volte presentano anomalie in una o più funzioni del pacemaker che possono influenzare lo stato clinico attuale; dato che in ICU si possono riscontrare frequentemente pazienti con pacemaker, risulta utile avere familiarità con le basi delle loro funzioni e disfunzioni.
La North American Society of Pacing and Electrophysiology e la British Pacing and Electrophysiology Group hanno creato un codice internazionale composto da cinque lettere per descrivere le funzioni del pacemaker, noto come il codice pacemaker NBG. Le prime tre lettere descrivono le funzioni antibradicardia, la quarta descrive la programmabilità della risposta in termini di frequenza e la quinta descrive le funzioni antitachicardia. Un pacemaker può trasportare una classificazione (ad esempio, DDD), ma essere in grado di diverse modalità di funzionamento, a seconda di come è stata programmato. Chiaramente la tipologia di impostazione dipende anche dal numero di sonde che vengono posizionate nel paziente.
Il pacemaker si compone di due parti: un generatore di impulsi e dei cavi che collegano il generatore al cuore; il generatore di impulsi è costituito da una batteria al litio e da tutta la circuiteria per rilevare e analizzare il ritmo cardiaco e produrre l'output elettrico. La batteria può durare più di 10 anni a seconda del tipo di programmazione; alla fine della sua vita, mostra una diminuzione graduale, non un brusco drop-off. I pacemakers contengono anche un interruttore reed che può essere utilizzato per valutare la capacità di stimolazione del pacemaker; quando un magnete esterno viene posizionato sul generatore di impulsi, il reed chiude il circuito, disabilitando il meccanismo di rilevamento. L'unità quindi si attiva in modo asincrono senza riguardo per il ritmo sottostante del paziente.
Ogni stimolatore è programmato per generare attività elettrica dopo un periodo massimo in cui non è stata rilevata alcuna attività; questo è chiamato il l'intervallo inferiore, ed è il tempo massimo tra due battiti consecutivi non stimolati. L'intervallo di fuga è il tempo che intercorre tra un complesso originale e il successivo complesso da pacemaker. Un leggero ritardo al di là dell'intervallo inferiore può essere programmato nel pacemaker quando si rileva un complesso QRS nativo. Questo è un tentativo di consentire al cuore di generare un ritmo autonomo e quindi preservare la funzione in modo più fisiologico; questo è chiamato frequenza di isteresi, e si trova spesso nei pacemaker a domanda ventricolare. Pacemakers bicamerali hanno un intervallo programmato tra i picchi atriale e ventricolare chiamato l'intervallo AV, che funziona sostanzialmente come l'intervallo PR; l'intervallo tra un picco ventricolare e il prossimo picco di stimolazione atriale è l'intervallo ventricoloatriale.
COMPLICAZIONI:
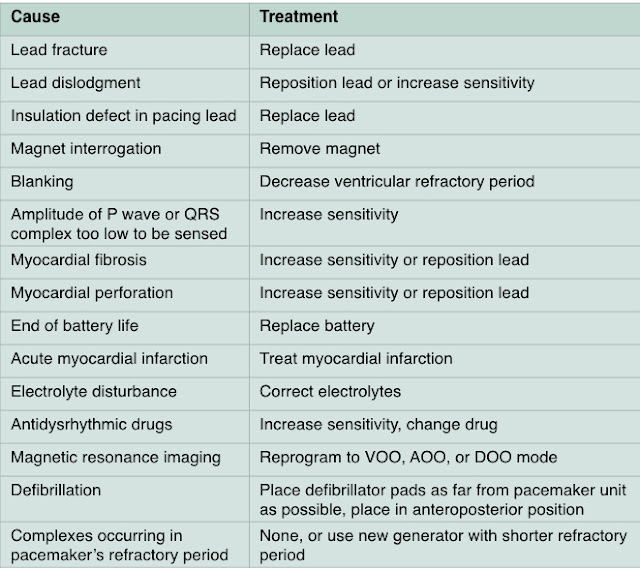
Un undersensing (mancato sensing) si verifica quando il pacemaker genera un uscita elettrica, indipendentemente del ritmo di base del paziente; si identifica un picco è visto ad un intervallo prima dell'intervallo inferiore. L'uscita del pacemaker poi compete con ritmo intrinseco del paziente. Sebbene la stimolazione ventricolare possa presentare un problema quando la soglia di cattura ventricolare è stata modificata, e la stimolazione atriale erronea può produrre una fibrillazione atriale, questi sono raramente problemi urgenti, anche se devono essere migliorati.
Un underpacing (mancato pacing) si sviluppa quando un picco di pace-maker non si genera dopo che l'intervallo inferiore è stato superato (tranne quando l'isteresi è stata programmata); un oversensing si verifica quando gli stimoli sono percepiti erroneamente come output del pacemaker. Come risultato, l'uscita corretta prevista è inibita. La mancanza del ritmo può essere una complicanza devastante per un paziente pacemaker-dipendente. È importante determinare se l'uscita è veramente avvenuta o meno. Un ECG a 12 derivazioni dovrebbe essere fatto, perché i picchi possono essere troppo piccolo per essere visto in una sola derivazione.
Una mancata cattura si verifica quando un pacemaker scarica come previsto, ma non riesce a depolarizzazione il miocardio; un piccolo picco del pacemaker è individuabile sull'ECG, ma nessun complesso QRS segue immediatamente. Questo può essere pericoloso per un paziente pacemaker-dipendente e può richiedere una stimolazione temporanea fino a quando il problema viene risolto. La maggior parte dei casi sono dovuti a problemi con l'interfaccia sonda/tessuto miocardico, anche se anche si possono verificare problemi isolati nei cavi o più raramente nel miocardio.
Quando un cavo è inserito nel miocardio, la fibrosi del tessuto avviene nelle prime 4-6 settimane; poiché il tessuto cicatriziale non conduce come un miocardio normale, può essere necessario aumentare la tensione di uscita. La sindrome di Twiddler si vede quando un paziente si agita con il generatore e finisce per tirare i cavi dai loro allegati al miocardio; generalmente viene confermata dalla radiografia del torace; il pacemaker viene pertanto sostituito e fissato saldamente alla fascia sottostante. La perforazione del ventricolo tipicamente si verifica subito dopo che i cavi sono posizionati e viene confermata da una radiografia del torace che mostra la punta della sonda fuori del cuore. A condizione che il paziente non sia anticoagulato, la perforazione è generalmente ben tollerata in fase acuta; l'ecocardiografia può valutare la presenza di versamento pericardico o tamponamento. Il riposizionamento dell'elettrodo è in genere eseguita in sala operatoria dopo che la coagulopatia è stato invertita.
Un aumento della soglia per la cattura può anche essere causato da ischemia miocardica, alterazioni metaboliche o da alcuni farmaci; il trattamento definitivo generalmente comporta la correzione della malattia di base.
(continua...)
REFERENCES:
1. Rubart M, Zipes DP: Genesis of cardiac arrhythmias: electrophysiological considerations. Libby P Bonow RO Mann DL Zipes DP Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 8th ed 2007 WB Saunders Philadelphia 727
2. Cheitlin MD, Sokolow M, McIlroy MB: Clinical cardiology. 6th ed 1993 Appleton & Lange Norwalk, Conn p. 486-94
3. Rotman M: Bradyarrhythmias in acute myocardial infarction. Circulation 1972;45:703-722
4. Zimetbaum PJ, Josephson ME: The evolving role of ambulatory arrhythmic monitoring in general clinical practice. Ann Intern Med 1999;130:848-856
5. Cole C: Bradyarrhythmias, atrioventricular block, asystole, and pulseless electrical activity. Marso SP Griffin BP Topol EJ Manual of Cardiovascular Medicine. 2000 Lippincott Williams & Wilkins Philadelphia 282
6. Sneddon AJF, Camm AJ: Sinus node disease: current concepts in diagnosis and therapy. Drugs 1992;44:728-737
7. Olgin JE, Zipes DP: Specific arrhythmias: diagnosis and treatment. Libby P Bonow RO Mann DL Zipes DP Braunwald’s Heart Disease: a Textbook of Cardiovascular Medicine. 8th ed 2007 WB Saunders Philadelphia 863-933
8. Dawkins S, Hobson AR, Kalra PR, et al.: Permanent pacemaker implantation after isolated aortic valve replacement: incidence, indications, and predictors. Ann Thorac Surg 2008;85:108-112
9. Reid JM, Coleman EN, Doig W: Complete congenital heart block. Br Heart J 1982;48:236-239
10. Bernstein AD, Camm AJ, Fletcher AD: The NASPE/BPEG generic pacemaker code for antibradyarrhythmia and adaptive rate pacing and antitachycardia devices. Pacing Clin Electrophysiol 1987;10:794-798
11. Epstein AE, DiMarco JP, Ellenbogen KA, et al.: ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: Executive Summary: a Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2008;51:2085-2105
12. Untereker F, Shepard RB, Schmidt CL, et al.: Power sources for implantable pacemakers. Ellenbogen KA Kay GN Wildoff BL Clinical Cardiac Pacing. 1995 WB Saunders Philadelphia 91-111
13. Bernstein AD, Parsonnet V: Survey of cardiac pacing in the United States in 1989. Am J Cardiol 1992;69:331-338
14. Thakur RK: Permanent cardiac pacing. Gibler WB Aufderhide TP Emergency Cardiac Care. 1994 Mosby St Louis 385-428
15. Sgarbossa EB: Recent advances in the electrocardiographic diagnosis of myocardial infarction: Left bundle branch block and pacing. Pacing Clin Electrophysiol 1996;19:1370-1379
16. Mitrani RD, Myerburg RF, Castellanos A: Cardiac pacemakers. Fuster V Alexander R O’Rourke R Hurt’s The Heart. 10th ed 2001 McGraw-Hill New York 987
17. Fishberger SB, Mehta D, Rossi AF, et al.: Variable effects of adenosine on retrograde conduction in patients with atrioventricular nodal reentry tachycardia. Pacing Clin Electrophysiol 1998;21:1254-1257
18. Roguin A, Schwiter J, Valhous C, et al.: Magnetic resonance imaging in individuals with cardiovascular implantable electronic devices. Europace 2008;10:336-346
19. Gammage MD: Temporary cardiac pacing. Heart 2000;83:715-720
20. Kenyon CJ, Aldinger GE, Joshipura P, et al.: Successful resuscitation using external cardiac pacing in beta adrenergic antagonist–induced bradyasystolic arrest. Ann Emerg Med 1988;17:711-713
21. Heard K, Kline JA: Calcium channel blockers. Tintinalli JE Kelen GD Stapczynski JS Emergency Medicine: A Comprehensive Study Guide. 6th ed 2004 McGraw-Hill New York 1108-1112
22. Francis GS, Williams SV, Achord JL, et al.: Clinical competence in insertion of a temporary transvenous ventricular pacemaker. Circulation 1994;89:1913-1916














0 Response to "Bradiaritmie (Capitolo 2.5.2a)"
Posting Komentar