In Medicina Intensiva le complicanze addominali sono frequenti, rappresentando una quota importante di patologie che comportano il ricovero in ICU ed essendo spesso complicanza di un’altre condizioni patologiche, spesso di situazioni complesse. Quando si parla di peritonite primaria (chiamata anche peritonite batterica spontanea) si intende una infezione microbica del fluido peritoneale in assenza di perforazione intestinale, ascessi o infezioni localizzate del tratto gastroenterico. è una condizione patologica che spesso occorre in pazienti con cirrosi o ascite, ma anche nei bambini. La diagnosi si conferma con il riscontro di batteri nel fluido peritoneale e/o con un riscontro di leucociti intra-peritoneale superiori a 500 cell/mmq. Per peritonite secondaria invece si intende una peritonite batterica o fungina secondaria alla perforazione di un viscere, con ingresso di materiale infettivo nella cavità peritoneale. Infine la peritonite terziaria è dovuta alla persistenza dell’infiammazione addominale con segni clinici di irritazione a seguito di una peritonite secondaria.
EPIDEMIOLOGIA:
Nei pazienti cirrotici l’incidenza di peritonite batterica spontanea si aggira attorno al 10-30%, mentre le forme secondarie sono rare (circa 1 ogni 20 forme primarie) e dipendono dall’eziologia iniziale (di cui il 2% si hanno in caso di danno di origine non infettiva), 10% si sviluppano in un contesto post-chirurgico per una patologia infettiva ed un 50% in caso di ischemia intestinale gangrenosa. Per quello che riguarda la peritonite terziaria si può arrivare alla persistenza cronica di infiammazione post-infettiva fino al 50-75% dei pazienti con peritonite secondaria di grado severo. La mortalità globale per le forme primarie si aggira attorno al 15-50%, mentre le forme secondarie varia fra il 20-90%, condizione che evolve sempre negativamente se non si interviene anche mediante la chirurgia (diversamente dalle forme primarie, dove una laparotomia esplorativa si associa ad una mortalità intrinseca fino all’80%). La diagnosi ed il management precoce si sono dimostrati in grado di ridurre la mortalità e la morbidità, anche se nei pazienti oltre 65 anni il rischio di morte è aumentato per via delle co-patologie.
DEFINIZIONI:
La pressione intra-addominale è la pressione che in condizioni standard si trova nella cavità peritoneale, che costantemente aumenta durante l’inspirio e si riduce durante l’espirio in respirazione spontanea. Una semplice valutazione clinica (mediante un esame obiettivo esterno) non è sufficiente per valutare e definire la pressione intra-addominale, in quanto la pressione intraddominale (IAP - Intra-Abdominal Pressure) è funzione della pressione che si applica agli organi interni; vedremo più avanti come poter pertanto misurare in maniera accurata la IAP; i valori normali di IAP sono inferiori a 5 mmHg.
Si parla di ipertensione intra-addominale quando si ha una IAP aumentata oltre 12 mmHg in maniera sostenuta; data la definizione di ipertensione addominale, può stratificare in grado I quando la pressione é fra 12-15 mmHg, in grado II quando le pressioni sono fra 16-20 mmHg, in grado III quando le pressioni sono fra 21-25 mmHg ed infine in grado IV quando le IAP sono superiori a 25 mmHg. Bisogna porre attenzione alla definizione, perché un aumento di pressione addominale, anche severo, non pone di per sé diagnosi di sindrome compartimentale addominale. Difatti, la sindrome compartimentale addominale è una condizione patologica caratterizzata da una pressione intra-addominale oltre 12 mmHg associata alla comparsa di un danno d’organo.
La incidenza di ipertensione addominale varia in base ai valori che si utilizzano ed ai limiti di pressione che si prendono in considerazione: tipicamente si aggira fino al 10-20% dei pazienti di medicina ricoverati in ICU, al 30% dei pazienti post-chirurgia addominale elettiva e fino al 50-75% dei pazienti di chirurgia d’urgenza/traumatica. L’incidenza di sindrome compartimentale addominale varia invece fra il 2-5% nei pazienti di medicina, arrivando fino al 5-35% nei pazienti chirurgici. La presenza di ipertensione addominale di grado III e la sindrome compartimentale addominale aumentano di 3-5 volte il rischio di morte.
FISIOPATOLOGIA:
L’ipertensione addominale (ed ancora di più la sindrome compartimentale addominale) é una condizione clinica che può avere ripercussioni multiorgano. Gli effetti fisiopatologici di un aumento di pressione in un vano chiuso (quale é l’addome) sono ben descritti in altre regioni corporee (ad esempio nel caso di pneumotorace iperteso, tamponamento pericardico, aumento della pressione intracranica, sindrome compartimentale degli arti, ecc…); similmente il volume della cavità addominale è limitato dalla sua componente di trazione data dalla fascia addominale. In uno spazio chiuso, un aumento di volume si traduce inevitabilmente in un aumento di pressione; quando la IAP supera 20 mmHg, la compliance addominale si riduce nettamente e come risultato dei piccoli aumenti di volume provocano forti aumenti della IAP.
Il primo elemento da prendere il considerazione la pressione venosa centrale transmurale (PCVtm), che può essere calcolata mediante la formula:
PVCtm = CVPee - IAP/2
Dove per ee si intende la misurazione della PVC alla fine dell’espirazione e per IAP si intende la pressione intra-addominale. Si comprende bene come la pressione intravascolare della Vena Cava Inferiore dipende dalla differenza fra la pressione che si misura all’interno del vaso (generalmente mediante la posa di un CVC) e la pressione che si trova all’interno della cavità addominale. In caso di aumento di tale pressione, pertanto, si assiste ad una riduzione della pressione transmurale, con 1) riduzione del ritorno venoso e 2) rischio di collasso vascolare (se IAP/2 equivale alla PCVee).
La seconda conseguenza é la riduzione del ritorno venoso al cuore destro (si veda il capitolo dedicato alla fisiologia dell’atrio destro, Capitolo 2.7.2), con riduzione della gittata cardiaca che inizialmente viene compensata dalla tachicardia e dall’aumento delle resistenze vascolari periferiche. Con l’avanzare dell’ipertensione addominale, si assiste ad una riduzione tale del ritorno venoso da determinare una riduzione della gittata cardiaca e quindi della perfusione d’organo periferica.
Oltre a questo, a livello degli organi addominali si assiste ad una venostasi importante che, associata alla ipoperfusione (per il meccanismo citato poc’anzi), comporta una sofferenza ischemica dei diversi organi, in particolare a livello addominale (soprattutto il rene, il fegato e l’intestino). Anche a livello metabolico bisogna ricordarsi che in caso di problematiche addominali spesso concomitano complicanze renali ed epatiche per cui eventuali metaboliti di farmaci possono accumularsi in circolo. A livello renale è importante monitorare la diuresi oraria, sapendo che l’oliguria può essere espressione sia di una sindrome compartimentale addominale (da considerare per IAP oltre 20 mmHg) che fare seguito ad uno stato settico; si deve pertanto iniziare una CVVHDF non appena indicato. A livello epatico la sua funzione può essere misurata in maniera poco invasiva tramite la misurazione della clearance plasmatica del verde di indiocianina.
L’ultimo elemento é la compromissione respiratoria, dato che gli aumenti della IAP si riflettono in una espansione della cavità addominale a scapito dell’espansione toracica, con conseguente riduzione della compliance respiratoria. La riduzione dell’ossigenazione, l’ipoventilazione generale e la bassa gittata concorrono infine a generare una ipoperfusione ed ipossigenazione sistemica.
Alcuni recenti studi di laboratorio hanno dimostrato che la decompressione di una sindrome compartimentale addominale provoca l’aumento di espressione nei neutrofili circolanti di CD11b (elemento collegato ai recettori di adesione cellulare). La decompressione della sindrome compartimentale addominale è anche associata con il rilascio di citochine nella circolazione portale e aumento della permeabilità del polmone, similmente a quello che si osserva dopo uno shock emorragico e rianimazione (ischemia-riperfusione), provocando un danno polmonare più intenso di quello che appare prima della decompressione.
RICONOSCERE I PROBLEMI:
Generalmente un paziente con un problema addominale acuto richiedente chirurgia d’urgenza è solitamente seguito da una degenza in ICU, per controllare il decorso post-operatorio e/o perché spesso la patologia di base non è ancora totalmente risolta.
ANAMNESI:
Il sintomo cardine è il dolore addominale, che viene classificato per tipologia, sede, severità, cronologia e durata; il dolore viscerale appare come protopatico, poco localizzato con un carattere di malessere profondo, generalmente secondario alla distensione o spasmo di un organo cavo. Il dolore parietale è ben localizzato e pungente, nascente da una irritazione peritoneale. Il dolore riferito è un dolore percepito vicino alla superficie del corpo e dolente. La presenza di dolore addominale non sempre correla con la gravità della situazione clinica; rappresenta una sintomo importante ma non l’unico. La sede iniziale di dolore, la cronologia di comparsa e l’andamento, assieme alla irradiazione dello stesso possono dare suggerimenti in merito all’organo interessato. Possono inoltre essere presenti sintomi associati come la caratteristica delle feci, nausea/vomito, febbre, sintomi genito-urinari, alterazioni cutanee, medicamenti concomitanti, ecc…
ESAME OBIETTIVO:
Alla visita clinica si devono ricercare i segni concomitanti di SIRS/sepsi come febbre, tachicardia, diaforesi, ipotensione ed oliguria. Quando si posiziona la sonda naso-gastrica si deve valutare la quantità/qualità del materiale refluente, così come si deve eseguire una valutazione rettale.
- Valutazione eziologica: si deve cercare di comprendere la causa del problema per poter agire risolvendo essa stessa; si deve valutare la storia attuale/pregressa di chirurgia addominale, la presenza di suture sotto tensione, la persistenza di aria libera addominale post-chirurgica (oltre 7 giorni) e/o la presenza/precedenza di infezioni addominali.
- Valutazione severità: non esiste uno score diretto o singolo in grado di valutare un paziente con sepsi addominale; generalmente si utilizzano il SOFA score e l’APACHE II score, associato alla classificazione della ipertensione addominale e/o alla presenza di sindrome addominale compartimentale.
- Sintomi associati: possono esserci nausea/vomito, diarrea, febbre, sintomi di SIRS/spesi, dolore addominale (spesso sintomo cardine ma non l’unico), alterazioni emodinamiche (ipotensione arteriosa su ridotto ritorno venoso), alterazioni respiratorie, alterazioni cutanee ed alterazioni renali (a rischio di sindrome compartimentale o ipotensione su ridotto pre-carico).
LABORATORIO:
Negli esami di laboratorio si esegue una valutazione in merito al fegato/vie biliari (transaminasi e indici di colestasi, cooagulazione), al pancreas (amilasi, lipasi), all’intestino (lattati, LDH, CK), all’ematocrito, agli indici di infiammazione, ecc… Vanno inoltre aggiunti gli opportuni esami batteriologici (come emocolture, prelievo di ascite, ecc…) in base alla situazione clinica generale. Per la valutazione dell’ascite si eseguono esami di diverso tipo come la coltura, la conta cellulare ed il differenziale, la ricerca della tubercolosi (se si sospetta), le analisi biochimiche (proteine, albumina, glucosio, LDH, amilasi, bilirubina, trigliceridi, colesterolo, ecc…), il gram e l’esame citologico (se si sospetta una neoplasia). Si aggiunge poi la classica differenza trasudato/essudato (che esula dalla spiegazione attuale).
ESAMI DIAGNOSTICI AGGIUNTIVI:
Per quello che concerne la radiologia, si esegue un radiogramma standard del torace (se possibile in ortostasi) per valutare la presenza di aria libera infra-addominale, altrimenti si esegue un addome in decubito laterale se le condizioni del paziente sono instabili. Si ricerca aria libera (segno di perforazione addominale), distensione delle anse e tipologia di distensione (tenue/colon, ileo meccanico/paralitico, ecc…). In alcune situazioni di maggiore urgenza e/o dove si vogliono avere informazioni più accurate si esegue una TC-addome. L’ecografia addome si utilizza prevalentemente per l’analisi degli organi parenchimali addominali e per le strutture vascolari; viene inoltre utilizzato per la ricerca di ascite ed in caso di trauma addominale (sospetto/certo) per eseguire l’analisi rapida della presenza di emoperitoneo. Infine, in queste situazioni, la laparoscopia viene utilizzata a scopo diagnostico quando le indagini diagnostiche precedenti non hanno portato ad alcuna soluzione diagnostica e/o quando le condizione cliniche del paziente sono talmente instabili dove è mandatorio eseguire una terapia precoce, ricercandone direttamente la causa mediante apertura delal cavità addominale.
MISURAZIONE DELLA PRESSIONE ADDOMINALE:
Come abbiamo avuto modo di dire, l’esame clinico dell'addome è impreciso per determinare la presenza di ipertensione intra-addominale; pertanto una misura standardizzata di IAP è fondamentale per la definizione di ipertensione intra-addominale e per impostare un’adeguata terapia.
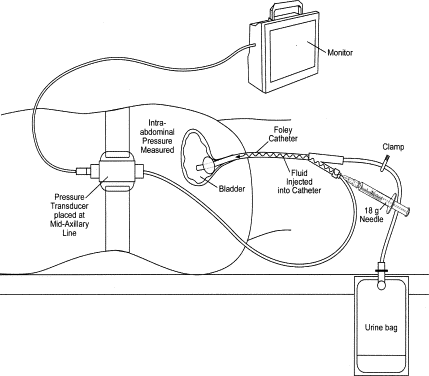
La IAP è stata storicamente misurata in quasi tutti i quadranti addominali, ma la tecnica intravescicale usando un normale catetere urinario sembra essere il metodo più affidabile e meno invasivo. La logica è che la IAP è trasmessa alla vescica urinaria, che funge da trasduttore di pressione quando viene riempita con soluzione fisiologica. Gli studi fisiologici hanno dimostrato che un minimo di 20 ml di soluzione fisiologica sono sufficienti per ottenere una misurazione accurata: la pressione è condotta dal fluido della vescica nel catetere urinario, che viene bloccato durante l'intervallo in cui viene misurata la IAP. La pressione nel tubo del catetere può essere misurata con un raccordo a T con un rubinetto a tre vie rubinetto, collegando un lato ad un trasduttore di pressione.
La tecnica intravescicale ha dimostrato di correlare bene con IAP misurata direttamente mediante un insufflatore laparoscopico. La via vescicale appare più accurata rispetto all'uso di sonde rettali e gastriche, che tendono a fornire diverse letture, a seconda della posizione del paziente. Gli studi sugli animali hanno dimostrato che la pressione nella vena cava inferiore correla bene con la pressione vescicale, ma l’uso della vena cava inferiore e sonde peritoneali dirette sono più invasive. Questa tecnica è relativamente semplice e può essere effettuata in qualsiasi ICU in cui un trasduttore di pressione è disponibile. Diversi dispositivi proprietari sono disponibili a livello clinico. Lo svantaggio é l’impossibilità di misurare la pressione in continuo e che ottenenere una misura precisa sono stati calcolati circa 7 minuti di tempo da parte dell’infermiere, limitando pertanto la frequenza con cui le misurazioni possono essere ottenute.
TERAPIA:
Il trattamento della sindrome compartimentale addominale richiede una terapia di supporto accanto ad una terapia eziologica, ponendo molta attenzione alla terapia che, anche se apparentemente sembra essere adeguata, può aggravare la fisiopatologia sottostante. Un esempio é la compressione toracica da parte dell’addome, che comporta un’ipossiemia per shunt su atelettasie basali. In questo caso una terapia con incremento della PEEP - che apparentemente può sembrare una terapia adeguata per il meccanismo fisiopatologico intrinseco al polmone, può diventare deleterio a livello emodinamico. Se la sindrome compartimentale addominale riduce il ritorno venoso (per riduzione della PVCtm), un ulteriore aumento della pressione intra-toracica (tramite aumento di PEEP) si traduce in un aumento di pressione in 2 compartimenti continui (torace ed addome), portando ad un elevatissimo rischio di arresto cardiaco per ipotensione arteriosa. Similmente, la somministrazione di fluidi (con l’idea di aumentare la PVC e mantenere aperta la vena cava per aumentare il ritorno venoso e riempire il sistema emodinamico) alla lunga non fa altro che aumentare la venostasi a livello addominale, aggravando il danno d’organo (soprattutto intestinale).
Quando un paziente sviluppa un quadro di ipertensione addominale, prima di eseguire un intervento chirurgico di decompressione (che come abbiamo visto si associa ad alterazioni citochiniche importanti ed aumenta la mortalità del paziente) si deve cercare di poter risolvere il problema tramite tecniche mediche che si possono classificare in 5 steps successivi.
Il primo elemento é lo svuotamento del contenuto intra-luminale, svuotando il lume gastrico (tramite aspirazione e sospensione della nutrizione enterale), somministrando procinetici (Metoclopramide 10 mg IV, Eritomicina 100 mg IV, Neostigmina 2 mg IV lenti) per favorire lo svuotamento intestinale, svuotare l’ampolla rettale e/o eseguire una decompressione endoscopica del grosso intestino. Il secondo elemento é l’evacuazione di fluidi addominali, intervenendo nella rimozione dell’ascite e/o nel drenaggio percutaneo di eventuali collezioni liquide intra-addominali. Il terzo elemento é la correzione del leak capillare, somministrando albumina con diuretici dell’ansa e/o si utilizzando la dialisi/ultrafiltrazione: l’albumina si somministra solamente dopo che si è eseguito il controllo della fonte, in quanto la somministrazione di colloidi durante la sepsi ha un impatto prognostico negativo. Il quarto elemento é migliorare la complicance addominale tramite la sedazione del paziente e/o l’utilizzo di miorilassanti (compatibilmente con il quadro clinico del paziente). Solo quando la IAP continua ad incrementare o persistere (con le conseguenze multi-organo descritte precedentemente) nonostante le manovre mediche e/o il paziente sviluppa una chiara sindrome compartimentale addominale, allora è necessario l’intervento di laparotomia decompressiva, che risulta essere l’unico trattamento definitivo, con rivalutazione ogni 24-48 ore per la possibile richiusura addominale.
Quando viene eseguita una laparotomia decompressiva, l’addome non può più essere richiuso fino a quando l’edema addominale persiste. Deve essere pertanto impostata una chiusura addominale temporanea, mantenendo la fascia addominale aperta. Per l’intensivista é importante discutere con il chirurgo sulla tipologia di trattamento che verrà eseguito, discutendo di volta in volta i benefici/rischi di ogni tecnica. Gli obiettivi principali della chiusura addominale temporanea sono la prevenzione dell’eviscerazione, la gestione di uno spazio sufficiente per il contenuto addominale, la regolazione dei fluidi peritoneali, la prevenire dalle infezioni e la preservazione della fascia e della pelle per l’eventuale chiusura e ricostruzione. Nel corso degli ultimi 15 anni, la morbidità e la mortalità sono significativamente diminuite, ma questa strategia porta ancora notevoli complicanze a lungo termine, quali fistole, infezioni addominali e raccolte addominali. Per la gestione della chiusura addominale temporanea si possono utilizzare garze umide per coprire l’addome (ma con il rischio di provocare fistole intestinali) o la towel clip closure dove si utilizzano delle garze che vengono ancorate alla cute tramite opportune clip (appare un metodo preferito in caso di IAP elevata dopo la chirurgia d’urgenza in vista di una nuova esplorazione rapida). La borsa di Bogota prevede l’utilizzo di un sacchetto di plastica sterile con all’interno 3 litri di soluzione fisiologica in cui sono immersi i visceri, permettendo un rapido accesso visivo all’iintestino, ma con lo svantaggio di non permettere il controllare della perdita di fluidi peritoneali). Il Vacuum-assisted fascial closure (VAC) permette di inserire una spugna drenante con pressioni differenziali negative, e negli anni si é dimostrato un metodo semplice, efficace e che permette di stimare la perdita di liquidi.
REFERENCES:
1. Malbrain ML, Cheatham ML, Kirkpatrick A, et al.: Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. I. Definitions. Intensive Care Med 2006;32:1722-1732
2. Cheatham ML, Malbrain ML, Kirkpatrick A, Sugrue M, Parr M, De Waele J, et al.: Results from the conference of experts on intra-abdominal hypertension and abdominal compartment syndrome. Part II: Recommendations. Intensive Care Med 2007;33:951-962
3. Kron IL, Harman PK, Nolan SP: The measurement of intra-abdominal pressure as a criterion for exploration. Ann Surg 1984;199:28-30
4. Sanchez NC, Tenofsky PL, Dort JM, et al.: What is normal intra-abdominal pressure?. Am Surg. 2001;67:243-248
5. Balogh Z, McKinley BA, Holcomb JB, et al.: Both primary and secondary abdominal compartment syndrome can be predicted early and are harbingers of multiple organ failure. J Trauma 2003;54:848-861
6. Burch JM, Ortiz VB, Richardson RJ, et al.: Abbreviated laparotomy and planned reoperation for critically injured patients. Ann Surg 1992;215:476-484
7. Moore EE, Thomas G: Orr Memorial Lecture: Staged laparotomy for the hypothermia, acidosis and coagulopathy syndrome. Am J Surg 1996;172:405-410
9. Emerson H: Intra-abdominal pressures. Arch Intern Med 1911;7:754-784
11. Gross R: A new method for surgical treatment of large omphalocoeles. Surgery 1948;24:277-292
12. Rotondo MF, Schwab CW, McGonigal MD, et al.: “Damage control”: An approach for improved survival in exsanguinating penetrating abdominal injury. J Trauma 1993;35:375-382








0 Response to "Addome in ICU (Capitolo 4.1)"
Posting Komentar